
 我要投稿
我要投稿
摘要:
最近,嘌呤能信号通路被认为是针刺镇痛(AA)的细胞机制。Geoffrey Burnstock和Maiken Nedergaard通过扩展关于AA(针刺镇痛)过程中内源性阿片释放的假设,为嘌呤受体(P2和P1/A1受体)参与AA的有益作用提供了证据。鉴于标准止痛剂对某些疼痛状态(如神经病理性疼痛)的治疗效果不佳,以及阿片类药物和非甾体抗炎药物的许多副作用,寻找替代治疗方案具有十分重要的意义。由于对AA的临床研究有时会产生不同的结果,动物实验结果就显得尤为重要,需通过严格的统计方法对数据进行评估,包括与足够数量的对照组进行比较。本文就P2受体参与AA的研究现状作一综述,并对该领域未来的发展趋势进行展望。
前言:
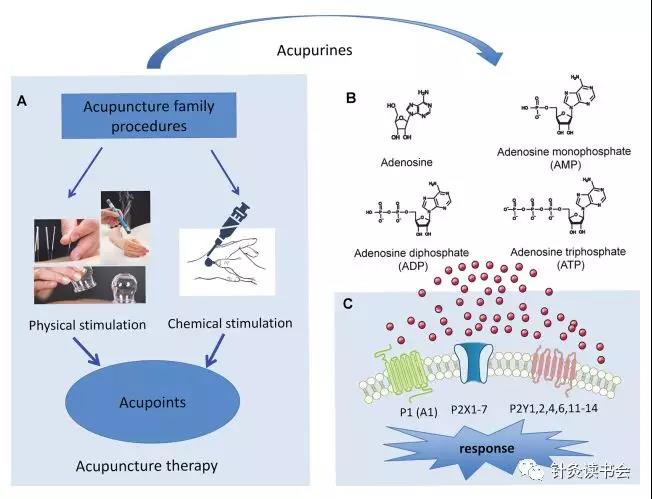
嘌呤能信号系统包括ATP,ADP,AMP和腺苷(ADO),以及两个家族的嘌呤受体P1和P2,分别对应ADO和ATP/ADP(UTP/UDP)。这些受体在哺乳动物的大多数细胞类型中都有表达,但在无脊椎动物或更原始的生物中也有表达。P1Rs由A1、A2A、A2B和A3四种亚型组成,均与G蛋白偶联。P2R分为两个家族:P2X和P2Y。P2XRs是配体门控的阳离子通道,形成P2X1-7亚型,P2YRs属于G蛋白偶联受体,由P2Y1,2,4,6,11-14亚型组成。
ATP/ADP浓度与针刺刺激
ATP及其代谢产物ADP是与P2受体结合的主要嘌呤能配体。在生理条件下,细胞内ATP浓度在3-5 mM之间,用于储存能量;它们在厌氧条件下被动员。伤害性刺激、剪应力、拉伸、渗透肿胀或代谢限制会导致ATP/ADP从受害细胞的内部释放到胞外空间。典型的情况是,嘌呤能受体半数最大激活所需的ATP浓度为3-500 nM,比细胞内存在的浓度低1000倍,就足以启动嘌呤能受体介导的信号传递。ATP被释放到胞外空间后,作用于P2Rs,并被不同的胞外核苷酸酶降解为ADP、AMP和ADO。P2X7R型对三磷酸腺苷的灵敏度在100-1000μM范围内,是独一无二的。下图显示了导致ATP局部释放和其功能活性代谢物产生的AP家族程序,以及这些嘌呤能激动剂作用的受体类型。目前,有关针刺后细胞外ATP浓度变化的资料很少。在雄性小鼠中,针刺作用于足三里穴,针刺每5分钟轻轻旋转一次,持续30分钟,微透析探针检测到的肌肉/皮下组织中所有被检测到的嘌呤(ATP、ADP、AMP和ADO)的细胞外浓度(ATP、ADP、AMP和ADO)在距穴位0.4-0.6 mm的范围内急剧升高。在30min针刺过程中,ADO浓度增加了24倍。ADP、AMP和ADO在AP后60min仍明显升高。然而,细胞外ATP浓度在针刺后不久就恢复到基线。在健康志愿者中,AP(针刺)也会导致ADO的持续显著增加,但针刺过程中ATP的浓度不会增加。这些发现已经表明,在小鼠和人类志愿者中,AP的镇痛作用是由ADO而不是ATP引起的。下面的实验数据进一步支持了这一观点。
Deoxycoformycin阻断AMP脱氨酶和ADO脱氨酶,这两种酶有助于从ATP生成胞外ADO。小鼠腹腔内应用Deoxycoformycin后,肌肉/皮下组织中ADO的浓度明显升高,且明显延长了小鼠的抗伤害性反应。因此,细胞外的ADO最有可能是由释放的ATP酶产生的,而不是由ADO本身从细胞内部进入间质的。
SD大鼠体内实验和体外肥大细胞培养实验提供了不同形式AP刺激后ATP浓度变化的数据。雀啄手法针刺大鼠右胫前肌膝下7~8 mm处(未命名穴位),每分钟重复30次,持续1min,可使细胞外ATP、ADP和ADO浓度明显升高,AMP浓度未见升高。MA后60min,四种嘌呤类物质均恢复到基线水平。有人提出,MA引起的ATP浓度增加可能来自骨骼肌细胞,而不是血管细胞或感觉神经。另一项测量ATP浓度的实验是在大鼠颈部切口疼痛模型上进行的。颈切口后4、24、48h颈脊髓背侧ATP含量增加。一次EA干预进一步提高了三个EA组(LI18、LI4-PC6和ST36-GB34)的ATP水平。但经过两次EA干预后,LI18组和LI4-PC6组ATP水平均下降,三次EA干预后又恢复到正常水平。ST36-GB34的EA在术后24 h和48 h无明显变化。EA似乎只会引起ATP浓度的突然而短暂的升高,而ATP浓度随后会迅速降低。
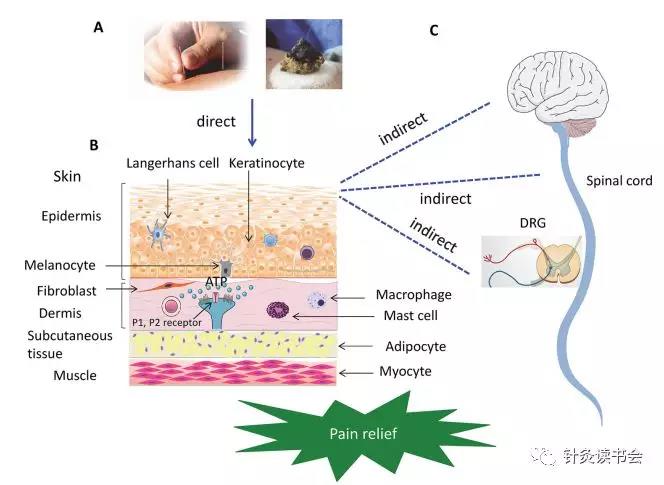
事实上,在大多数AP家庭治疗过程中,穴位皮肤治疗是一项必要的措施。因此,目前的数据表明,穴位的肥大细胞参与针刺、艾灸和激光针灸治疗的镇痛机制。在人肥大细胞系HMC-1细胞的体外实验中,用低渗溶液灌流细胞,在43°C或52°C温育时产生热,用657 nm波长的红激光照射细胞,诱导细胞产生机械应力。研究发现,所有这些刺激都能诱导人HMC-1细胞ATP释放,这种释放与细胞内游离Ca2+浓度的增加有关。
基于上述数据表明,AP刺激诱导皮肤/皮下组织或肌肉细胞释放ATP,皮下或足底内应用ATP和α,β-meATP可分别引起急性疼痛和神经病理性疼痛的伤害性反应和痛觉过敏/痛觉。我们决定提出以下问题:(1)释放的ATP会促进还是削弱AA?(2)ATP的释放是否仅是局部ADO释放的前期过程,而ADO影响针刺镇痛?(3)目前的临床试验表明,应用于肌肉组织的深度针刺或非穴位的假针灸所产生的效果与实际针灸的效果相似,皮下组织或肌肉细胞中ATP浓度的增加能否解释AA产生的镇痛作用?(4)穴位处其他细胞释放的ATP,如角质形成细胞、成纤维细胞、上皮细胞或内皮细胞、Merkel细胞或Langerhans细胞有何作用?关于AP通过激活P2X/P2YR,或通过激活A1R的酶降解途径转变为ADO,参与疼痛缓解的概念,可见下图。
2.P2X3和P2X2/3受体在针刺镇痛中的作用
大多数研究AP刺激释放的嘌呤(Acupurines)在AP介导的镇痛中所起的作用,包括神经病理性疼痛、炎性疼痛和内脏疼痛,这些疼痛是通过不同的穴位针对不同的疼痛形式而产生的,其中P2X3Rs或P2X2/3Rs在AP介导的镇痛中起着重要的作用。
在慢性压迫损伤引起的神经病理性疼痛(CCI)中,从CCI后7天开始,EA应用于同侧或对侧穴位,每天30分钟,共7天。痛觉过敏和痛觉异常是神经病理性疼痛的两种症状,共观察14天。在观察的前7天,这两种症状的严重程度逐渐增加,然后达到峰值。上述AP治疗方案逆转了约40%的神经病变,机械性疼痛和温度感觉的恢复几乎相同,但同侧和对侧EA后的恢复程度几乎相同。第10天,鞘内注射选择性P2X3R拮抗剂A317491 立即显著地促进了EA诱导的镇痛效应。在本试验中,A317491 仅与EA结合使用,而不是单独使用,因此很难确定这两个效应是否为叠加性效应。如果是叠加效应,那么镇痛的机制是相同的,均为通过排除P2X3R的功能来介导的。然而,同侧和对侧EA的同等效应表明,是脊髓或脊髓上水平而不是DRG神经元调控了EA的镇痛作用。
对糖尿病神经病理性疼痛(DNP)和炎症性疼痛,用2Hz和100Hz频率刺激足三里穴和昆仑穴,观察EA的作用。在DNP大鼠中,通过缩足爪退缩测量的热痛觉过敏大大减少。2 Hz的EA的镇痛作用强于100 Hz。应用免疫荧光技术检测P2X3R蛋白在腰椎(L4-L6)背根神经节中的表达。有趣的是,2 Hz的EA降低了DNP大鼠L4-L6背根节P2X3Rs表达,而100 HzEA仅在L5和L6 DRG上降低了P2X3Rs的表达。低频EA累及脊髓节段较多,并伴有DRG的作用,2 Hz较100 Hz有较强的镇痛作用。相反,当向右后爪注射Freund‘s完全佐剂(CFA)引起炎性疼痛时,100 Hz EA产生的镇痛效应比2 Hz的EAP更强。然后计数P2X3免疫阳性神经元数目,Western印迹法检测P2X3R蛋白表达。炎症痛使L4、L5、L6 DRGs中P2X3阳性神经元数量增加,L6中P2X3蛋白表达增加,而L4、L5 DRGs中P2X3蛋白表达无明显变化。100 Hz EAP可明显减少L4~6 DRG中P2X3免疫阳性神经元的数量,下调L6 DRG中P2X3蛋白的表达。
AP也可抑制内脏痛。在肠易激综合征疼痛模型中,为了确定大肠扩张引起的疼痛反应的强度,采用了疼痛退避反射评分。EA后(ST37和ST25)评分呈可逆性下降。P2X2和P2X3 mRNA在DRG中的表达也分别随球囊在结肠中的扩张和EA的增加而增加和降低。P2X3mRNA在结肠肌间神经丛、脊髓、前额叶皮质和扣带回前部也有类似的变化。因此,我们假设P2X3Rs沿着介导疼痛的神经通路被上调到中枢。尽管如此,我们仍然有一些合理的怀疑,因为在研究中没有报告准备RT-PCR的脊髓的标准。当然,由合适的DRG支配的L4-L6脊髓节段应该准备好(最好只包括背角的背侧部分)并进行RT-PCR处理。这些研究的主要缺陷是,在实验设计中几乎总是缺少假EA;然而,在非穴位针刺也是一个必要的对照。
3.P2X4受体与针刺镇痛
2003年首次报道了P2X4Rs与神经病理性疼痛的产生有因果关系。结果发现,鞘内注射大剂量三硝基苯基ATP(TNP-ATP,P2X1-4Rs的拮抗剂)而不是PPADS(P2X1-3,5,7Rs的拮抗剂),可迅速而短暂地逆转第五腰(L5)脊神经损伤所致的机械性异位症。鞘内注射P2X4R反义寡核苷酸也能减少伴随神经病理性疼痛的脊髓P2X4R蛋白表达,防止机械性痛觉的发展。最后得出结论,位于脊髓小胶质细胞的P2X4Rs介导神经病理性疼痛,P2X4Rs在脊髓中的敲除阻止了周围神经损伤后机械性痛觉的发展。小胶质细胞P2X4Rs的激活似乎导致脑源性神经营养因子(BDNF)的合成和释放。这种BDNF可能通过下调神经元氯转运体KCC2而改变背角第一层神经元的跨膜阴离子梯度,从而导致GABAA-和甘氨酸-R介导的抑制转化为兴奋。因此,小胶质细胞P2X4Rs在神经病理性疼痛的发病机制中起着重要作用。
于CCI手术后第二天,EA(2 Hz频率)刺激环跳穴,每天刺激30min,共刺激14d,均可显著提高大鼠的足爪退缩阈值(P<0.0 5,P<0.01)。EA可抑制P2X4和干扰素-γ(IFN-γ)在大鼠脊髓中的表达。鞘内注射IFN-γ也能促进小胶质细胞上P2X4Rs的出现。但鞘内注射IFN-γ后,其镇痛作用不明显。结论:EAP通过下调脊髓组织中γ的过度表达,从而降低P2X4Rs的表达,从而减轻周围神经损伤后的触觉异位症。另有研究表明,上巨虚穴和天俞穴实施EA不仅能显著降低内脏高敏感大鼠的腹缩反射评分,而且还能降低结肠和脊髓P2X4R的免疫反应活性(P<0.05或P<0.05),提示EA对结肠和脊髓的P2X4R免疫反应有明显的抑制作用,但对结肠和脊髓的P2X4R免疫反应无明显影响。
4.P2X7受体与针刺镇痛
P2X7R是P2XR超家族中一个不寻常的成员。首先,其C末端域比其他超家族成员长约200个氨基酸,参与调节受体的功能,包括信号通路的激活、细胞定位、蛋白质-蛋白质相互作用和翻译后修饰。其次,P2X7R可以作为功能性受体,即经较低浓度的ATP激活后的非选择性阳离子通道,但在高浓度大直径的ATP作用下可形成长时间的激活。测量分子质量高达900Da的非选择性孔隙。P2X7Rs参与慢性炎症和神经病理性疼痛的第一个证据来自目前P2X7R缺陷小鼠的一项研究,一般认为P2X7Rs也与骨癌性疼痛、域外面部疼痛、糖尿病性神经病理性疼痛、慢性术后疼痛和慢性炎症和神经病理性疼痛相关的慢性疼痛敏感性有关。
P2X7Rs诱导促炎症细胞因子白细胞介素-1β(IL-1β)迅速成熟和释放,并在外周和中央免疫细胞(淋巴细胞、单核/巨噬细胞、小胶质细胞、星形胶质细胞)中分布,使它们成为神经免疫界面的关键分子。P2X7R拮抗剂(如A-438079)的系统性应用在神经病模型和炎症性疼痛模型中产生了剂量依赖性的抗伤害效应。TAT-P451是一种与P2X7R C末端结构域相对应的肽,它能阻止孔隙的形成,但不能阻止阳离子通道的活动,只有在具有孔隙形成的P2rx7等位基因的小鼠中,它才能选择性地减轻神经损伤和炎性异位症。在神经病理性疼痛的情况下,位于卫星胶质细胞(感觉神经节中的星形胶质细胞样细胞)的P2X7Rs会引发炎症反应。因此,阻断P2X7Rs不仅可以改变炎症性疼痛,还可以减轻与神经损伤相关的疼痛。
P2X7Rs在AA中的作用已经在三种不同类型的疼痛模型中进行了测试。本文首次对艾灸治疗内脏痛觉过敏进行了研究。在这一系列实验中,使用了一种新的艾灸手法-热敏艾灸(HSM)。即:艾灸大肠俞(BL25)或附近非穴位(BL25外1 cm),艾灸4次/d,连续8天。免疫组织化学、实时荧光定量RT-PCR和WESTERNBLOTTING表明,HSM能显著降低L6-S1背根节的腹缩反射评分,并能抑制艾灸引起的L6-S1背根节P2X7Rs表达的上调(P<0.05或P<0.05),明显抑制球囊扩张所致的L6-S1 DRGs中P2X7Rs的表达。第二项研究是在环跳穴使用EA治疗CCI诱导的神经病理性疼痛。应用EA,频率2 Hz,30min/d。EA治疗在CCI手术或鞘内注射二苯甲酰ATP(BzATP)后的第二天开始,持续14天。环跳穴的EAP使第5天的缩足爪阈值增加,第7天的缩足爪潜伏期增加,并与对照组比较,差异有统计学意义(P<0.05)。EA还能抑制Cci或BzATP诱导的P2X7免疫反应性小胶质细胞的活化,同时抑制脊髓IL-1β和IL-18的过度表达。
最后,颈部切口疼痛模型也被用来强调P2X7Rs在AA中的作用。在异氟醚吸入麻醉下,用钳子沿双侧胸舌肌在甲状腺周围重复钝性解剖刺激30min,建立颈部切口疼痛模型。在颈部切口手术前后(每次EA干预后4h)检测热痛阈值。颈部切口手术采用异氟醚(2 Hz/100 Hz)双侧LI18或LI4-PC6双侧足三里(ST36)-阳陵泉(GB34)光麻醉下的EA刺激。实验证明,两次EAP刺激LI18和LI4-PC6,可减轻该疼痛模型颈部切口局部的热痛觉过敏,ST36-GB34则不能。这些结果提示,EA可能通过调节小胶质细胞内ATP释放和P2X7R活性,抑制Fractalkine/CX3CR1/p38MAPK诱导的神经元-小胶质细胞间串扰,从而维持颈切口早期内环境的稳定。
5.针刺镇痛:ATP与腺苷的功能
针刺后嘌呤是一种很有前途的信号分子,可以解释针灸的作用机制,尤其是在AA中。这补充了一种理论,即中枢阿片类物质主要负责AP引起的镇痛,此外,还解释了AP在人类患者中所观察到的有效性。有人提出,AP针对穴位的机械、电或热刺激以及艾灸或拔罐可导致ATP的释放,而ATP可被酶化降解为一系列具有生物活性的代谢物(ATP、ADP、AMP、ADO)。任何一种P2XR类型的刺激都会释放ADO,但这种可能性极小,迄今为止还没有实验证据证明这一点。AP通过作用于P2X3、4、7Rs而引起疼痛,而ADP通过作用于P2Y1、12Rs或通过作用于P2Y1或P2Y2Rs而引起镇痛。最终,ADO具有镇痛活性,尤其是通过A1R刺激,尽管在特殊情况下(炎症性疼痛,A2ARs;神经病理性疼痛,A3Rs),其他ADO受体类型也可能参与。
近10年来,A1Rs(P1Rs)参与介导AA的炎症和神经病理性疼痛。然而,进一步的实验表明P2X家族受体(P2X2-4,7)在炎性痛、神经病理性痛和内脏痛时,在外周和中枢感觉神经元中的表达和功能增强。不同穴位的EAP或艾灸均可产生镇痛作用,但可降低DRG、脊髓、前额叶皮质、伏核P2X3、4、7R型的易化表达,增加中脑导水管周围灰质P2X3、4、7R型的表达。
然而,P2XR类型的调节可能是抗伤害性感受的结果,而不是原因。任何一种AP刺激引起的局部或中枢ATP浓度升高,可能是由于ATP的酶降解导致组织中ADO水平升高所致。这种ADO随后可能作用于A1Rs,使痛觉正常化,从而导致P2X3R上调的逆转。然而,另一种可能性是,ATP通过P2X2-4,7Rs刺激其他神经元通路,而不是那些直接参与介导疼痛刺激的神经通路,从而导致镇痛。其中P2X3Rs位于DRG神经元胞体或其周围和中央终末,P2X7Rs存在于外周免疫细胞或感觉神经节的卫星胶质细胞上。位于中枢神经系统的其他P2XR类型也可能参与。
6.其他相关问题
6.1 已证明不同形式的AP刺激会释放ATP,从细胞内部到细胞外空间。局部ATP水平升高在AP镇痛中的作用是什么?局部ATP是只作为酶产生的ADO的来源,还是ATP/ADP通过刺激P2X和P2YRs参与AA?
6.2 根据P2X受体对ATP的高亲和力(P2X1,P2X3Rs)、对ATP的低亲和力(P2X2-5rs)和对ATP的极低亲和力(P2X7Rs),将P2X受体分为三大类:(1)对ATP的高亲和力(P2X1,P2X3Rs),(2)对ATP的低亲和力(P2X2-5rs),(3)对ATP的极低亲和力(P2X7Rs)。有的P2XRs快速脱敏(P2X1,3Rs),有的则缓慢脱敏。除了一系列P2XRs之外,P2YRs还可能参与AP诱导的镇痛。更重要的是,不同嘌呤受体(如P2X4和P2X7,P2Y1和P2X3)或疼痛敏感嘌呤受体和非嘌呤受体(如TRPV1和P2X3,ASIC3和P2X3)之间的相互作用可以微调AP的镇痛作用,因此,应该澄清所有这些因素,还是只有一些因素主要参与AA。
6.3 在ICD-11(国际疾病分类第11修订版)中,慢性疼痛分为7大类:慢性原发性疼痛、慢性癌性疼痛、慢性创伤后和手术后疼痛、慢性神经病理性疼痛、慢性头痛和口面部疼痛、慢性内脏疼痛和慢性肌肉骨骼疼痛。用AP治疗其他类型的疼痛(下腰痛、癌痛、偏头痛、膝骨关节炎)的临床试验表明,AP能够缓解疼痛。问题是,在这些疼痛条件下,哪种类型的P2受体尤其与AA有关?
6.4 在大多数嘌呤在AA中的作用研究中,真正的问题是只在某些情况下使用选择性P2X3Rs拮抗剂,而P2X4和P2X7R拮抗剂则根本没有用过。为了阐明嘌呤受体在AP镇痛中的作用,有必要使用多种新的实验工具和方法。这些领域从分子生物学到基因工程(敲除、基因编辑)、高通量测序、光遗传学、钙成像、只由特定药物激活的受体(DREADD)等。
6.5 尽管皮下应用证明它能引起疼痛,作为P2受体配体的三磷酸腺苷(ATP)已在临床试验中得到测试,并在静脉或鞘内应用时显示出镇痛作用。其镇痛作用可能是由于ADO的降解和ADOR的激活所致。目前尚无关于急性胰腺炎后血液或脑脊液中ATP浓度的数据。此外,一个迫在眉睫的问题是,所涉及的P2受体(P2X7、P2Y12)的单核苷酸多态性是否也可能改变AP对疼痛的缓解,或有助于在镇痛方面区分AP的应答者和无应答者。
7.结论:
虽然有明确的证据表明各种形式的AP刺激局部释放ATP,并且这种ATP是ADO的前体,它激活神经元A1Rs,引起镇痛效应,但ATP本身在这些过程中的作用还远未被了解。ATP是一种感觉递质/调节剂,在连接外周部位和高级中枢的所有级别的神经元疼痛通路中增强伤害性感受。P2X3Rs定位于感觉神经元本身,P2X4Rs(小胶质细胞)和P2X7Rs(小胶质细胞、星形胶质细胞、少突胶质细胞)主要位于胶质细胞。因此,P2X3Rs能直接调节神经元的功能,而P2X4/P2X7Rs通过间接的神经胶质细胞串扰发挥作用。痛刺激增加背根节、脊髓腹角、中脑导水管周围灰质、伏隔核和前额叶皮质P2X3、4、7R mRNA和蛋白的含量。据报道,AP可以抵消这种增加的受体密度,从而提高痛阈。尽管进行了大量的实验工作,但AP的这一作用是否除了与酶分解产物ADO占据A1Rs有关外,还与P2X/P2YR活化有关,目前还不清楚。在这方面必须考虑P2X3Rs的脱敏作用和P2Y1Rs的镇痛作用。然而,可能的假设是P2X3,4,7Rs的激活可能是通过刺激其他神经通路而不是直接参与介导疼痛刺激的神经通路来改变痛觉。
Tang Y, Yin HY, Liu J, Rubini P, Illes P. P2X receptors and acupuncture analgesia. Brain Res Bull. 2018 .
