
 我要投稿
我要投稿
核心产品特瑞普利单抗销售收入超3亿元
抗PD-1单抗“拓益”(特瑞普利单抗)是君实生物自主研发的首个商业化产品,2018年12月17日获国家药品监督管理局(NMPA)有条件授予上市批准,用于既往接受全身系统治疗失败的不可切除或转移性黑色素瘤的二线治疗,今年2月底实现全国销售。
2019年1季度报显示,1个月左右的时间,特瑞普利单抗便实现了7907.54万元的收入。虽然定价较低,但特瑞普利单抗的增长速度不容小觑,2019年上半年,销售收入为3.08亿万元,其毛利为87%。
除获批的黑色素瘤适应症外,截至6月30日,特瑞普利单抗已开展11项临床试验(II期或III期),包括鼻咽癌、尿路上皮癌、黑色素瘤、非小细胞肺癌、三阴性乳腺癌、食管癌及肝细胞癌等。进一步验证在治疗不同瘤种方面的安全有效性,扩大受益患者人群。
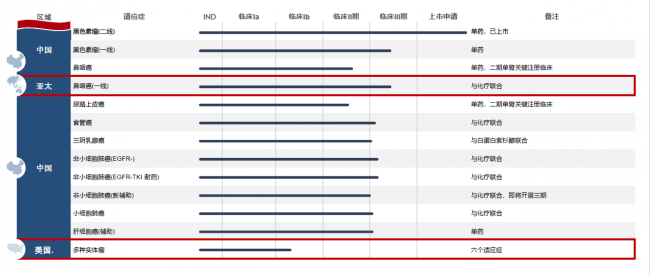
拓益主要临床试验进展情况
研发投入继续保持高速增长,同比增幅69%
在研发方面,上半年研发开支3.69亿元,同比增幅69%。报告期内公司研发投入继续保持高速增长,关键临床试验取得重大进展。
利用公司自主研发核心平台,以及与第三方的合作,君实的产品线扩展至19项在研药品。包括13项肿瘤在研药品、2项代谢疾病在研药品、3项针对炎症或自身免疫性疾病药品及1项治疗神经性疾病药品。

君实生物研发管线进展
除PD-1单抗外,还布局了自身免疫性疾病TNF-α靶点单抗修美乐生物仿制药,这也是君实生物首款生物类似药;国内首款经NMPA批准在中国用于高脂血症治疗临床试验的抗PCSK9单克隆抗体;还有自主研发、具有完全自主知识产权、全球首个治疗肿瘤重组人源化抗BTLA单克隆抗体注射液,已获得FDA药物临床试验批准;自主研发重组人源化抗IL-17A单克隆抗体注射液(JS005)临床试验申请获得NMPA受理。
此外,与Anwita签署《许可协议》在大中华区(包括中国内地、台湾、澳门及香港)开发及商业化IL-21融合蛋白(AWT008);从华奥泰处受让阿瓦斯汀单抗生物类似药(HOT-1010)的现有研发成果并获得其后续技术支持。
完成产能升级,将打造一流质量体系
目前,中国市场获批上市的PD-1药物达到5个,行业竞争激烈。作为一种大分子抗体,其生产过程复杂,加之中国患者需求量大,可以说,PD-1药物的产能以及质量将成为竞争的关键。
2019年上半年,君实生物位于苏州吴江的生产基地已完成产能升级,从500L商业产能,扩展至3000L商业产能。此外,上海临港生产基地预计在研产品的生产及验证将于今年下半年进行。上述扩展将君实的总产能增加至33000L,将为商业化生产及临床试验需求提供支持。
此外,8月19日,前CDE首席科学家王刚加盟君实生物,全面负责生产质量及相关工作。王刚在生物药品审评和检查领域颇具资历,将带领团队在产能快速扩大的情况下,建立世界一流的生产质量管理体系,以保证产品质量的稳定、持续符合CGMP标准。
目前,君实正在申请于上海证券交易所科创板上市,并于2019年4月25日向中国证券监督管理委员会上海证监局报送了科创板上市辅导备案材料。
