
 我要投稿
我要投稿
非小细胞肺癌(non-smallcell lung cancer,NSCLC)是致死率极高的一类恶性肿瘤,居我国恶性肿瘤发病率及致死率之首[1]。近年来,肿瘤免疫治疗成为研究的热点,同时给NSCLC药物研究带来新希望。机体免疫系统通过免疫监视清除肿瘤细胞,然而当程序性死亡分子1配体(PD-L1)高表达后,导致机体免疫功能被抑制,肿瘤细胞逃避机体免疫监视和T细胞的杀伤作用[2]。研究表明,在NSCLC实体瘤中常见PD-L1过度表达[3]。因此,寻找抑制PD-L1的药物将成为治疗NSCLC的新方向。
人参皂苷Rg3是多种人参皂苷成分中免疫调节作用最显著的小分子物质,研究表明人参皂苷Rg3可通过多种途径增强机体对肿瘤细胞的免疫能力[4]。然而人参皂苷Rg3与免疫检查点之间的关联研究较少。人参皂苷调节免疫发挥抗肿瘤的作用是否与调控PD-L1表达有关尚不明确。本研究对人参皂苷Rg3影响PD-L1表达的作用进行研究,并初步探索其作用机制,为抑制PD-L1的中药新药开发提供参考。
1 材料
1.1 细胞
小鼠非小细胞肺癌Lewis细胞(LLC)源于ATCC细胞库。
1.2 药品与试剂
人参皂苷Rg3(成都曼思特生物科技有限公司,质量分数98.44%,批号MUST-16030711);DMEM基础培养基、胎牛血清(Gibco公司);RIPA裂解液+PMSF(北京鼎国昌盛生物技术有限公司);磷酸酶抑制剂(江苏凯基生物技术有限公司);ECL化学发光试剂盒(Millipore公司);MTT(Promega公司);γ干扰素(IFN-γ,Peproted公司);IFN-γ稀释液(杭州联科生物技术有限公司);流式细胞术PD-L1抗体(eBioscience公司);免疫荧光PD-L1抗体、GAPDH抗体(Proteintech公司);哺乳动物雷帕霉素靶蛋白(mTOR)抗体(Abclonal公司);蛋白激酶B(Akt)、p-Akt、PI3抗体(CST公司);山羊抗小鼠IgG H&L(Abcam公司);二抗(Bioword公司);DAPI染色液(Beyotime公司)。
1.3 仪器
CO2细胞培养箱,Thermo公司;酶标仪,美国BioTek公司;Flow Cytometer C6流式细胞计数仪,BD公司;荧光倒置显微镜,Zeiss公司;凝胶成像系统,美国Bio-Rad公司。
2 方法
2.1 MTT法检测人参皂苷Rg3对LLC增殖的影响
DMEM完全培养基(DMEM基础培养基+10%胎牛血清+青霉素+链霉素)培养LLC,PBS清洗2遍,胰酶消化,离心后计数,调整细胞数为8×103个/mL,接种于96孔细胞培养板,每孔加入200μL细胞悬液,培养12~24 h细胞待贴壁并显示形态。实验分为对照组及人参皂苷Rg3 1、2、4、8、16、32、64、128 μmol/L组。每组设置6个平行孔。5% CO2、37 ℃的饱和湿度培养箱孵育24、48 h后,弃去上清,各孔加入100 μL基础培养基DMEM和MTT 10 μL,孵育4 h,移除上清,各孔加入DMSO 100 μL溶解,震荡5 min混匀后,在490 nm处读取其吸光度(A)值。
2.2 长时程细胞动态监测人参皂苷Rg3对LLC增殖的影响
DMEM完全培养基培养LLC,PBS清洗2遍,胰酶消化,离心后计数,调整细胞数为8×103个/ mL,接种于96孔细胞培养板,每孔加入200 μL细胞悬液,培养12~24 h待细胞贴壁并显示形态。实验分组同“2.1”项。给药后置于CO2细胞培养箱中,培养24、48 h,每小时拍照记录进行细胞长时程动态监测。
2.3 流式细胞术筛选IFN-γ诱导PD-L1表达的有效浓度
取对数生长期的LLC,PBS清洗2遍,胰酶消化,离心后计数,调整细胞数为1×105/mL,接种于6孔板上,每孔加入2 mL细胞悬液。提前用稀释液配制不同质量浓度的IFN-γ。细胞分为IgG阴性对照组及IFN-γ 10、20、30 ng/mL组,每组设置3个平行对照孔。各组分别加入对应药物继续培养24 h,PBS清洗2遍,不含EDTA的胰酶轻轻吹打消化,1 000r/min、5 min离心后计数,调整细胞数为5×106个/mL。除阴性对照组外各组每200 μL体系加入1 μL PD-L1抗体,阴性对照组每200 μL体系加入1 μL山羊抗小鼠IgG。常温孵育15 min后500×g离心5 min,弃上清加入100 μL PBS重悬,采用Flow Cytometer C6检测PD-L1表达。
2.4 流式细胞术检测人参皂苷Rg3对LLC PD-L1表达的影响
取对数生长期的LLC,PBS清洗2遍,胰酶消化,离心后计数,调整细胞数为1×105个/mL,接种于6孔板,每孔加入2 mL细胞悬液。实验分为对照组、模型组及人参皂苷Rg316、32、64、128 μmol/L组,每组设3个平行孔。除对照组外每孔分别加入20 ng/mL的IFN-γ诱导PD-L1表达,培养24 h后,各给药组分别给予不同浓度的人参皂苷Rg3,对照组及模型组加入DMSO。继续培养24 h,检测各组PD-L1表达,方法同“2.3”项。
2.5 免疫荧光法检测人参皂苷Rg3对LLC PD-L1表达的影响
取对数生长期的LLC,PBS清洗2遍,胰酶消化,调整细胞数为1×105个/mL,接种于6孔板(内含细胞爬片),每孔加入2 mL细胞悬液。实验分组及处理同“2.4”项。继续培养24 h后,PBS洗涤,多聚甲醛固定10 min,0.1% TritonX-100透化10 min,1% BSA室温封闭30 min,一抗PD-L1(1∶10)4 ℃孵育过夜,山羊抗小鼠IgG(1∶1 000)4 ℃孵育2 h,Hochest33342孵育5 min,封片,荧光倒置显微镜下观察,放大400倍拍摄。
2.6 Western blotting法检测PI3K/Akt/mTOR通路相关蛋白表达
取对数生长期的LLC,接种于6孔板。实验分为对照组、人参皂苷Rg3 16、32、64 μmol/L组。培养24 h后,对照组给予DMSO,各给药组给予不同浓度人参皂苷Rg3。继续培养24 h,PBS清洗2遍,加入细胞裂解液(RIPA裂解液-蛋白酶抑制剂-磷酸酶抑制剂100∶1∶1)冰上裂解细胞,离心取上清,加入5×loading buffer(1∶4),100 ℃变性10 min,样品保存于−20 ℃。蛋白样品上样量25 μg,电泳条件40 A,100 min,转膜条件100V,90 min。加入一抗(mTOR、Akt、p-Akt、PI3K)4 ℃孵育过夜,二抗室温孵育2 h,TBST洗涤后ECL发光液显影。使用Gelpro凝胶分析软件进行蛋白条带灰度分析。
2.7 统计学分析
采用SPSS 17.0软件对实验数据进行统计学处理分析,结果以表示,各组间采用单因素方差分析比较,样本均数间比较采用LSD-t检验。
3 结果
3.1 人参皂苷Rg3对LLC增殖的影响
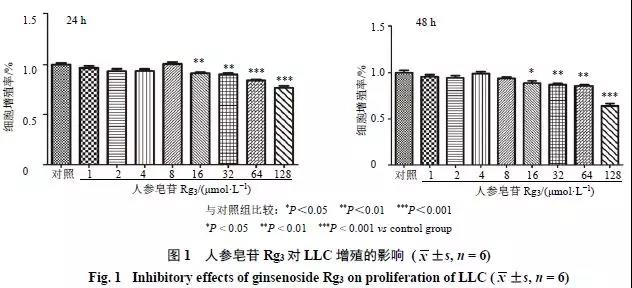
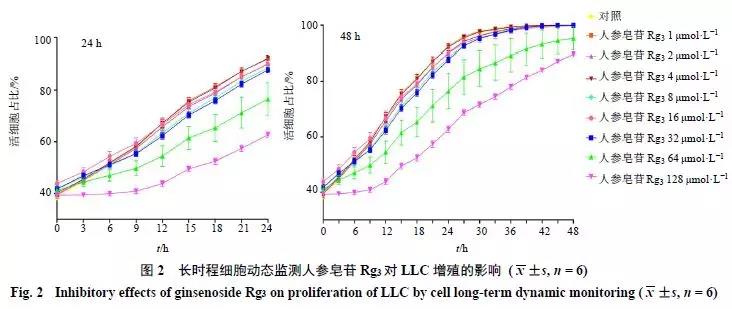
不同浓度的人参皂苷Rg3作用于LLC 24、48 h后,MTT结果显示(图1),人参皂苷Rg3在浓度为16、32、64、128 μmol/L时能够显著抑制LLC增殖,其他浓度下人参皂苷Rg3未明显抑制LLC增殖。24、48 h长时程细胞动态监测显示(图2),人参皂苷Rg3呈浓度依赖性地抑制LLC增殖。由此可见,人参皂苷Rg3能够显著抑制LLC增殖,其抑制作用呈现出时间和浓度依赖性。
3.2 IFN-γ诱导PD-L1表达的浓度筛选
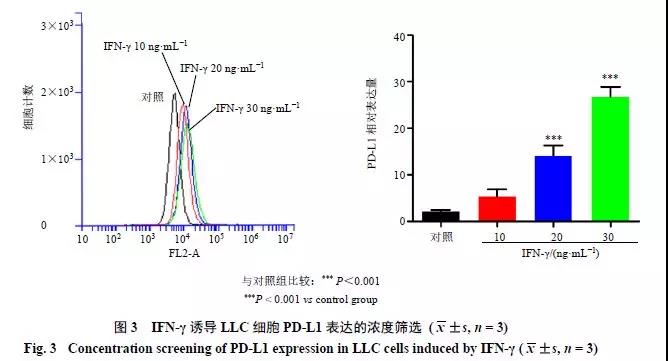
IFN-γ是协调肿瘤免疫应答的中枢细胞因子之一。肿瘤浸润淋巴细胞产生IFN-γ,进一步启动细胞周期停滞并诱导相邻肿瘤细胞的细胞凋亡[5]。然而,研究表明IFN-γ通过调控细胞周期素依赖蛋白激酶5(CDK5)上调PD-L1表达,促进肿瘤细胞免疫逃逸[6]。本实验分别采用10、20、30ng/mL的IFN-γ诱导PD-L1表达,结果(图3)显示IFN-γ质量浓度高于20 ng/mL时显著增加LLC中PD-L1的表达(P<0.001)。因此,在后续实验中选用20 ng/mL IFN-γ构建PD-L1高表达的LLC体外实验模型。
3.3 人参皂苷Rg3对LLC PD-L1表达的影响
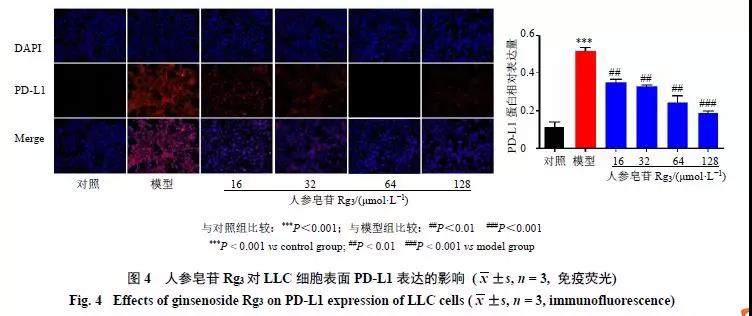
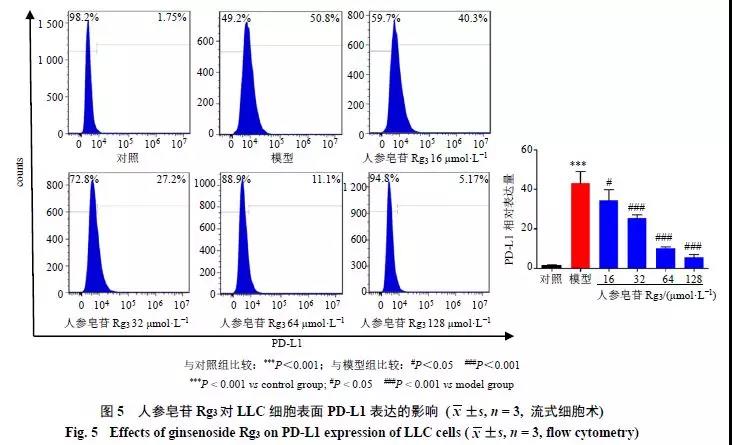
IFN-γ诱导PD-L1表达后,分别以人参皂苷Rg316、32、64、128 μmol/L干预LLC。免疫荧光结果显示(图4),与对照组比较,模型组PD-L1高表达于LLC细胞膜表面(红色),人参皂苷Rg3干预后,PD-L1表达显著降低(P<0.01、0.001)。流式细胞计数结果显示(图5),与对照组比较,模型组细胞PD-L1表达显著增加(P<0.001)。与模型组比较, 人参皂苷Rg3呈浓度依赖性地降低PD-L1的表达(P<0.05、0.001)。
3.4 人参皂苷Rg3对PI3K/Akt/mTOR通路相关蛋白表达的影响
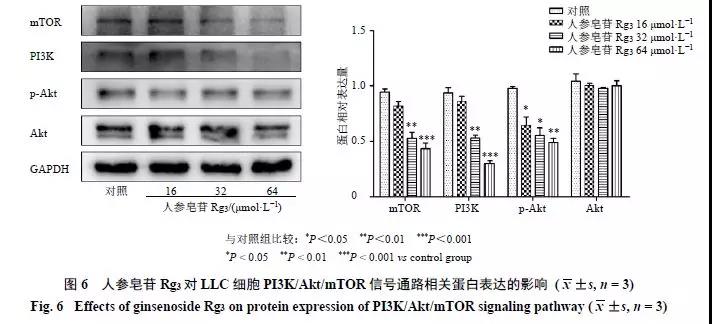
进一步研究人参皂苷Rg3的作用机制,由于PI3K/Akt/mTOR信号通路与PD-L1表达存在关联。因此检测肿瘤细胞中PI3K、mTOR、Akt、p-Akt的表达情况。Westernblotting结果表明(图6),人参皂苷Rg3 16 μmol/L组细胞p-Akt表达水平显著降低(P<0.05);人参皂苷Rg3 32 μmol/L组细胞mTOR、PI3K、p-Akt表达显著降低(P<0.05、0.01);人参皂苷Rg364 μmol/L组细胞mTOR、PI3K、p-Akt表达显著降低(P<0.01、0.001);各浓度下人参皂苷Rg3均不显著影响细胞Akt表达。人参皂苷Rg3可能通过下调PI3K、mTOR表达,抑制Akt活化,从而阻断PI3K/Akt/mTOR信号通路,进一步降低LLC表面PD-L1表达,阻断肿瘤细胞逃避免疫应答。
4 讨论
在传统中医学中,人参具有大补元气、复脉固脱、补脾益肺等功效[7]。人参中有效活性成分人参皂苷在调节免疫方面的作用尤为显著。现代药理学研究发现,人参皂苷通过以下方式影响机体免疫系统:通过保护固有免疫器官胸腺、脾脏、淋巴结等发挥抗病毒作用;增强树突状细胞、吞噬细胞、NK细胞等固有免疫细胞的免疫应答,杀伤病毒感染细胞及肿瘤细胞;调节细胞因子、补体等免疫分子产生免疫调节效应[8-10]。人参中含有近50种人参皂苷成分,其中多种成分均具有显著的抑制肿瘤细胞增殖、转移的作用。人参皂苷Rg3为四环三萜类原人参二醇型皂苷,存在2种构型,分别为20 (S)-型和20 (R)-型,其中20 (S)-型Rg3具有显著抗肿瘤效应,是众多R型人参皂苷中调节免疫和抗肿瘤作用最显著的有效成分[11]。
PD-L1表达于多种肿瘤细胞表面,其与T细胞上的PD-1相结合后,导致T细胞失活,无法杀伤肿瘤细胞,最终诱导免疫逃逸。NSCLC是最具攻击性和破坏性的恶性肿瘤之一。在NSCLC实体瘤中常见PD-L1过度表达,虽然PD-L1作为肺癌的生物标志物还存在争议,但是肿瘤细胞发生免疫逃逸的微环境中PD-L1的高表达值得关注[12-13]。免疫应答微环境涉及多种信号调节,包括信号传导及转录激活因子STAT3、Akt/mTOR或编码RAF家族丝氨酸/苏氨酸蛋白激酶BRAF的突变[14-15]。PD-L1的调节是复杂的,取决于潜在的转录和信号转导网络状态以及蛋白翻译水平。PI3K/Akt/mTOR信号通路是多种细胞过程中的重要调节因子,在70%的NSCLC病例中发生Akt/mTOR过度活化[16]。因此,PI3K/Akt/ mTOR通路与PD-L1存在紧密关联,抑制PI3K/Akt/ mTOR通路能够抑制PD-L1表达,阻断肿瘤细胞免疫逃逸。
目前,人参皂苷Rg3对PD-L1的作用研究较少。本研究通过MTT法及长时程动态监测验证人参皂苷Rg3可显著抑制LLC增殖。流式细胞术及免疫荧光结果显示人参皂苷Rg3调控IFN-γ诱导的PD-L1高表达。并且免疫印迹结果表明该作用通过PI3K/Akt/mTOR通路介导,从而增强T细胞的肿瘤细胞杀伤作用,抑制LLC增殖。本研究从免疫检查点PD-L1角度揭示了人参皂苷Rg3调节免疫、抗肿瘤的作用,为相关新药的研究提供了依据。
然而,本研究仅涉及体外实验部分。后续实验将对照人参皂苷Rg3对免疫正常小鼠以及免疫缺陷裸鼠的LLC移植瘤模型的影响进行体内验证,以及对人参皂苷增强T细胞活力的具体机制进行深入研究,以阐明人参皂苷Rg3通过调节免疫检查点PD-L1抑制NSCLC发生发展的机制。
参考文献(略)
来 源:王 蔚,王 旭,余苏云,黄 帅,丁语石,陈文星,王爱云,陆 茵. 人参皂苷Rg3调节免疫检查点PD-L1抑制肺癌Lewis细胞增殖的作用及机制研究 [J]. 中草药, 2019, 50(1):166-171.
