
 我要投稿
我要投稿
摘要
背景与目的:我们研究在急性和炎症性啮齿动物疼痛模型中,电针(EAP)和艾灸对各种酸和ATP敏感伤害感受器介导的疼痛状态的影响。
实验方法:我们向大鼠或小鼠的足爪中注入磷酸盐缓冲盐水(PBS;pH 6.0或4.0)或α,β-亚甲基ATP引起热超敏反应,该反应可通过足爪退缩潜伏期(PWL)进行定量。通过将完全弗氏佐剂(CFA)注射到大鼠爪中诱发炎症性疼痛。
结果:EAP和艾灸可以抵消酸敏感离子通道3(ASIC3)和瞬时受体电位香草酸1(TRPV1)通道介导的PWL在pH 6.0 PBS应答下的降低,但不能抵消仅由TRPV1通道介导的PWL的降低,这是通过注入pH 4.0 PBS。同样,EAP和艾灸可防止由嘌呤引起的疼痛,该疼痛是由P2X3(P2X2 / 3)和P2X7受体(Rs)的刺激引起的。EAP和艾灸也减轻了CFA的作用。
结论和意义:在急性热痛和CFA引起的炎性痛期间,ASIC3 / TRPV1通道和P2X3 / P2X7Rs分别被质子和外源性α,β-亚甲基ATP或内源性ATP激活。通过EAP /艾灸可以逆转由ASIC3 / TRPV1激活介导的低阈值急性酸性疼痛,而不能完全由TRPV1激活介导的高阈值酸性疼痛。ASIC3和P2X3R似乎通过形成对EAP /艾灸敏感的ASIC3 / P2X3“同源受体”,从而对质子和ATP相互作用。
关键字:酸性疼痛;炎性疼痛;镇痛;针刺;ASIC3;P2X受体
缩写:ASIC3,酸敏感离子通道3;BZ-ATP,二苯甲酰ATP;CFA,完全弗氏佐剂;EAP,电针;PBS,磷酸盐缓冲盐水;PWL,PAW停药潜伏期;R,受体;TRPV1,瞬时受体电位香草酸1;α,β-meATP, α,β-methylene ATP
介绍
在疼痛和痛觉过敏中局部酸中毒起主要作用。一方面,质子激活位于外围组织中的初级传入纤维上的痛觉受体(痛觉感受器),将信息传递到脊髓,并最终传递到高级大脑中心。这些痛觉受体主要代表瞬时受体电位(TRP)蛋白超家族的TRPV1成员以及酸敏离子通道(ASIC)家族的ASIC1a和ASIC3成员。另一方面,质子可以调节对受损组织释放的化合物(组胺,5-羟色胺,ATP)做出反应的各种受体的功能。例如,ATP通过受损的细胞膜离开细胞内部,并在较低浓度下激活P2X3(和P2X2/3),在较高浓度下激活P2X受体家族的P2X7亚类。
属于上皮性钠通道/去甲肾上腺素(ENAC/DEG)超家族的ASIC表现出与p2xrs高度的结构相似性。虽然两种受体通道类型的氨基酸组成不同,但它们的三聚体结构和离子传导途径相似。最近有研究表明,ASIC3和P2X3亚基并没有形成异分通道,而是紧密结合形成一个蛋白质复合物,介导单向抑制。
在过去的3000至4000年中,针灸疗法一直是中医的一个分支学科;它们是基于通过机械或热(艾灸)刺激刺激皮肤的某些穴位(穴位)和潜在的皮下组织。来自针灸基础和临床研究的越来越多的证据表明,疼痛对这种治疗手法特别敏感。镇痛似乎是由于炎症期间外周免疫细胞释放阿片肽,但也是由于大脑和脊髓中的阿片能神经元。最近,有人提出,ATP的局部释放及其可能的酶降解为腺苷是针灸诱导镇痛的原因。
由于针灸诱导镇痛的临床研究经常产生不同的结果,因此依靠在实验动物上进行的实验是非常重要的,并使用严格的统计方法评估数据,包括与足够数量的对照动物进行比较。例如,结合针灸应用,对酸敏伤害性感受器介导的疼痛的系统研究很大程度上是缺失的。
本研究的目的有三个方面:(1)阐明EAP/艾灸是否对酸性和嘌呤的疼痛有同样的影响;(2)了解低阈值和高阈值酸性疼痛是否受到EAP/灸法的差异调节;(3)研究体内ASIC3/P2X3Rs之间是否存在根据体外实验而建议发生的相互作用。我们报道,在急性酸性疼痛和完全弗氏佐剂(CFA)诱导的炎症疼痛中,ASIC3/TRPV1通道和P2X3/P2X7Rs分别被内源性释放的质子和ATP激活。此外,EAP/艾灸可防止由ASIC3/TRPV1激活介导的低阈值急性酸痛,而仅由TRPV1激活介导的高阈值酸痛则不能。ASIC3和P2X3Rs似乎通过形成对EAP/艾灸敏感的ASIC3/P2X3‘同源’受体来相互作用以响应质子和ATP。炎症性疼痛对这些针灸家庭程序也很敏感。
方法
动物:实验在429只成年雄性Sprague-Dawley大鼠(体重180-220g)、TRPV1基因敲除(ko;n=36)及其野生型(wt;n=29)对照(18-22g)上进行。p2x7r-ko小鼠(n=7)及其WT对照组(n=7;每只17-22g)是Jan M.Deussing博士(德国慕尼黑Max Planck精神病学研究所)赠予。我们在我们的动物屋里建立了trpv1和p2x7r-ko以及WT小鼠的群体。只有雄性大鼠和小鼠被用于实验,以排除任何性别依赖的变异性。动物7-8周龄,每个笼子饲养3-6个,在22-24℃的自然光/暗周期中,在我们的实验动物观察室中经历至少一周的驯化,可自由获得水和食物。实验程序根据国家卫生研究院“实验动物护理和使用指南”并经成都中医药大学动物伦理委员会批准。
药物应用方案:所有药物均通过足底内应用(i.pl.)。分别以100µl和20µl的体积注入大鼠和小鼠的左后爪。除CFA实验外,药物在-30分钟时间点的爪缩回潜伏期(PWL)基线测试后立即注射(见图1)。然后,每隔30分钟测量PWL,再测量120分钟。在炎性疼痛的实验中,测定PWL,然后立即将CFA细胞悬液(100µl)注射到大鼠的左后爪。随后,动物返回笼中24小时。然后,在30分钟时间点重新测定PWL,注射各种药理拮抗剂或应用EAP/艾灸30分钟(见图7)。此后以30分钟间隔共120分钟测量PWL。
电针与艾灸:EAP和艾灸在白天大致相同的时间(上午10:00至12:00)给醒动物,只需在EAP和艾灸期间通过两个尼龙搭扣和环扣以及固定在木块上的附加胶带固定。虽然固定肯定是一种压力刺激,假针灸应用于相同的穴位,但没有电刺激,或EAP传递到非穴位,两者都没有修改基线PWL值,与所有其他实验中测量的PWL值相比(比较图1e、h和图1a-d)。
EAP传递至足三里穴(ST36;位于左膝,小鼠约2 mm,大鼠约6 mm,腓骨头下方)。通过“穴位神经电刺激器”提供1 mA的大鼠或0.5 mA的小鼠电流,频率为15 Hz,持续30min。通过不锈钢针(长2.5 cm,直径0.25 mm;hwato-med)应用EAP。在ST36处,单方面引入皮肤下5-8毫米深(大鼠)或2-3毫米深(小鼠)。作为对照,假-EAP组大鼠进行同样的处理,但没有电刺激。在另一组大鼠中,刺激非穴位距ST36穴位约3 cm,朝向尾部并与膝关节相对。这个非穴位既没有在啮齿动物的穴位图中提到,也没有接近任何主要神经。
用直径为5 mm,长度为120 mm的艾条,在距皮肤约1 cm处单侧施灸30min至动物的左肢上。
热爪拔出潜伏期的测量:使用“热刺激仪”测定左后爪足底表面对热激光刺激的反应。仪器在使用前预热30分钟。将光束的强度调整为30%(对于小鼠为10%),并将截止时间设置为20s(在TRPV1KO小鼠中为30s)。尽管TRPV1 KO小鼠的基线PWL延长,但热刺激没有引起明显的组织损伤。所有测量都是在空调房间(22-24℃)中进行的。后爪的退缩、抖动被认为是对热刺激的反应。在测试开始之前,允许动物在玻璃体实验平台(800 Mm X 400 Mm X 165 Mm)顶部的透明塑料外壳(210 mm×210 mm x 160 mm)上适应30-40分钟,每个连续3天。基线PWL仅测定一次。然后,每隔30min测量大鼠和小鼠的PWL三次(每次间隔5min),包括以下六个时间点:基线(-30min)、0min、30min、60min、90min和120min。将大鼠和小鼠随机分配到其中一个试验组或对照组。对照组动物数量高于各实验组。我们通过对3组每组6-8只动物进行测量,将对照组(pH 7.4,PBS)中的动物数量增加到22只(与试验组的时间大致匹配)。三组在0min时间点的PWL值分别为12.3±0.4s(n=8),12.8±0.8s(n=6)和12.4±0.5s。由于这些值之间没有静态显着差异(P>0.05;F=0.236;等级上的Kruskal-Wallis方差分析),因此将它们汇集起来进行最终计算。在另一对照组(CFA,pH7.4,PBS),每组6-8只动物用于测量,并再次汇集不同时间获得的PWL值(12.9±0.4s,n=6;12.1±0.6s,n=8;P>0.05;Mann-Whitney Rank Sum检验)。否则,不进行不同试验组的样本量估计;他们整个过程由5到10只动物组成。大鼠或小鼠仅使用一次进行药物/针刺程序实验。
化学品和药物:5-[[(3-苯氧基苯基)甲基][(1s)-1,2,3,4四氢-1-萘基]氨基]羰基]-1,2,4-苯三甲酸钠盐水合物(A317491),3-[[5-(2,3-二氯苯基)-1H-四唑-1-基]甲基]吡啶盐酸盐(A438079),盐酸阿米洛利,2′(3′)-O-(4-苯甲酰基苯甲酰基)腺苷-5'-三磷酸三(三乙基胺)盐(BZ ATP),辣椒碱,完整弗罗因德佐剂细胞悬液(CFA),α,β-亚甲基ATP(α,β-MEATP),APETX2。UGR9-1是通过在大肠杆菌中生产重组类似物获得的。所有药物(A317491,1 mm;A438079,10 mm;APETX2,1 mm;BZ-ATP,10 mm;α.β-METAP,1 mm;UGR9-1,1 mm)的储备溶液均在蒸馏水中制备,但在DMSO中稀释的Capsazepine(1 mm)和阿米洛利(10 mm)除外。在磷酸盐缓冲盐中进行进一步稀释,其pH值通过添加0.1 N HCl或添加0.1 N NaOH(如果需要)设置为所需值(7.4、6.0或4.0)。
数据分析:所有数据均表示为n次观察的平均值±s.e.m,其中n表示每组动物的数量。使用SigmaPlot 13.0进行统计评价。我们测试并发现,当使用参数检验时,所有抽样分布都满足正态分布和等方差准则。通过单因素方差分析(One-way ANOVA),然后进行Holm-Sidak检验,或者在等级上重复测量方差分析(ANOVA),然后进行Tukey检验,在数据正态分布的情况下进行多重比较。通过Kruskal-Wallis ANOVA在等级上进行数据非正态分布的情况下进行多重比较,然后进行Dunn‘s检验。进行双向方差分析,然后进行Dunn‘s或Tukey测试,以比较在图3C,E和图6F中在KO和WT小鼠中获得的数据,以及比较在图2D,E中的时间点0和60分钟获得的数据。只有当F或H达到P<0.05时,才运行后期测试。两个数据集通过参数学生t检验或非参数Mann-Whitney秩和检验进行比较(视情况而定)。概率水平0.05或更低被认为具有统计学意义。
结论
药理拮抗剂、电针和艾灸对大鼠酸化痛的影响
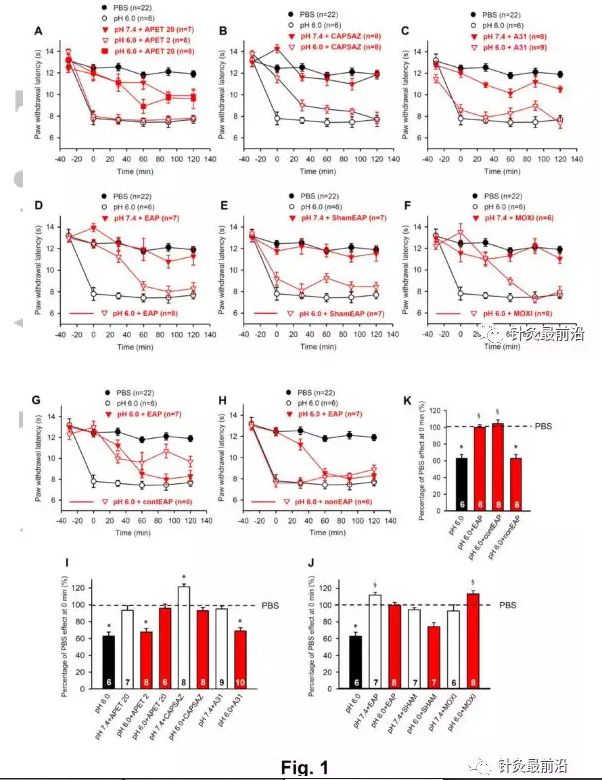
在所有实验中,使用热激光刺激器测量大鼠的爪缩回潜伏期(PWL),如方法部分所述。在左后爪中应用具有轻微碱性pH(7.4;称为“正常”)的PBS,不会导致PWL从-30min的第一次测量(13.2±0.2s)到0min和30min的第二次和第三次测量的变化。然而,与第一次测量(图1A-H)相比,观察到了统计学上显著的,尽管从60min开始第4次测量略有下降(11.8±0.3s;n=22;P<0.05;单向重复测量方差分析(卡方=18.953),随后是Tukey检验)。为了排除任何时间依赖性的变异性,我们决定将所有药物效应与它们的时间匹配对照进行比较。
与正常pH下PBS的作用相反,在-30分钟向左后爪注射中等酸性PBS(pH,6.0)导致0分钟时测量到的PWL明显缩短(图1A-H)。必须指出的是,随着时间的推移,注射部位的pH并不保持稳定。低pH值PBS的持续稀释预计会发生。尽管如此,令人欣慰的是,PBS注射的效果在整个实验过程中是绝对稳定的,因此这可能不会干扰结论的可靠性。
pH6.0PBS的作用在0min被ASIC3选择性海洋毒素APETx2(20µM;图1A)和选择性TRPV1拮抗剂capsazepine(10µM;图1B)消除,但不被选择性P2X3受体拮抗剂A-317491(300nM;图1C)消除。相反,在根据类似的应用方案进行的另一系列实验中,相同剂量的A-317491消除了α,β-亚甲基三磷酸腺苷(α,β-meATP;200nM)的影响(图4B)。同样值得注意的是,APETx2在较低剂量(2µM)下并未改变酸性PBS的效果,而在较高剂量(20µM)时会导致完全阻塞(图1A,I)。因此,我们在随后的所有实验中都使用了20µM的APETx2。
对图表的检查表明,APETx2(20µM)的拮抗作用持续时间长于Capsazepine(10µM)引起的拮抗作用(比较图1A和B)。有趣的是,APETx2(20µM)似乎在90分钟(pH 7.4 PBS,12.1±0.3 s,n=22 vs pH 7.4 PBS+APET,9.9±0.5 s,n=7)和120分钟(pH 7.4 PBS,11.9±0.3 s,n=22 vs pH7.4 PBS+APET,9.9±0.3,n=7)时间点(P<0.05);学生的t检验)。目前,我们没有对此结果的解释但是,在与数据评估相关的0分钟时间点,我们没有观察到APETX2(20µM)的任何影响。
此外,EAP(图1D)和艾灸(图1F)在-30分钟时间点分别施加30分钟,抵消由注射酸性PBS产生的PWL的减少。EAP和艾灸的作用持续时间大致相同(比较图1D和图1F)。在没有电刺激(“假EAP”)的情况下,将针刺入大鼠左后爪时,PWL继续降低以响应局部酸化(图1E)。此外,针灸应用于对侧后爪的ST36也干扰酸化引起的疼痛(图1G),而针灸传递到非穴位对这种疼痛质量没有任何影响(图1H)。
为了更好地比较药物和治疗引起的PWL变化,它们在0分钟表达为相对于0分钟正常PBS效应的百分比值(指定为100%并用虚线表示)(图1I-K)。所示的条形图证实了在图1A-H的基础上所做的结论,另外证明正常(pH 7.4)PBS与APETx2(20µM)和A317491(300 NM)结合在所施加的剂量下(图1I),以及EAP,Sham EAP,和单独艾灸(图1J),在没有酸性PBS注射液的情况下,不会改变药物或治疗效果的百分比。Capsazepine(10µM)延长正常PBS的作用,可能是因为它拮抗了其内源性激动剂对TRPV1的激活(图1I)。然而,刺激对侧足爪ST36抑制由酸性疼痛引起的热敏反应,用标准电参数刺激非穴位不能改变这种疼痛质量(图1K)。我们决定在药物应用后30分钟或开始α,β/艾灸后计算酸性PbS(EAP-meATP,BZ-ATP)诱导的敏感度增加的抑制,因为这种抑制在几乎所有情况下都在0分钟达到最大,之后没有变化或时间依赖性降低。
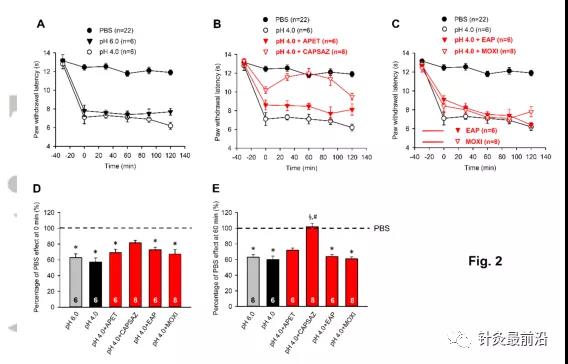
然后,我们研究了与以前相同剂量的使用过的药物和治疗对pH为4.0的PBS溶液引起的更强的局部酸化的影响(图2A)。pH从6.0降低到4.0并没有引起PWL的进一步增加(图2A)。尽管辣椒碱(10µM)可拮抗强酸性PBS的影响,并且这种效果甚至随时间增加,但APETx2(20µM)和EAP或艾灸都不会引起任何变化(图2B,C)。计算这些药物和治疗在0分钟(图2D)和60分钟(图2)的百分比效应。2E)证实了我们的发现。两个柱状图还显示,在0分钟时,辣椒碱仅对强酸化诱导的效应产生部分抑制,而在60分钟内完全抑制。相比之下,所有其他治疗方法的效果,而不是那些使用辣椒碱的治疗效果,随着时间的推移而保持稳定。
药物拮抗剂、电针和艾灸对野生型和TRPV1受体缺失小鼠酸化疼痛的影响
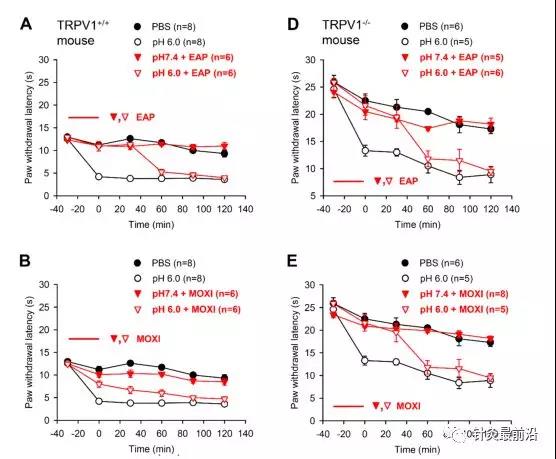
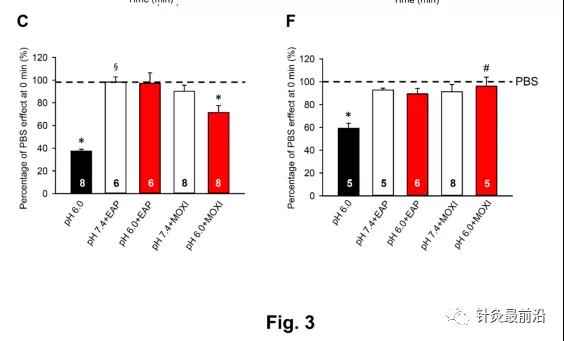
鉴于EAP和艾灸对局部酸化至pH 4、而不是pH 6的拮抗作用的降低,以及APETx2对后者的拮抗作用而不是前者的作用,我们决定比较EAP和艾灸对野生型和TRPV1基因缺陷小鼠(图3)pH 6.0诱导的PWL降低的调节作用。敲除小鼠的初始(预处理)PWL值(图3d;24.6±1.5s,n=5)高于野生型动物的相应值(图3A;12.9±0.4s,n=8,P<0.05;学生t检验)。这种差异是意料之中的,因为TRPV1是对皮肤、感觉神经末梢感受到的热做出反应的受体通道之一。通过对两种动物正常pwl在0 min时的百分比变化的评估,可以推断出eap的作用是相似的,尽管野生型小鼠pwl在ph 6.0pbs下的抑制作用似乎比敲除型小鼠更明显,尽管这种变化没有达到统计显著性水平(图3c,e)。与此相反,艾灸对敲除小鼠的作用大于野生型小鼠(图3C,E)。
最终,我们初步推测,在敲除小鼠中,ASIC3通道取代了TRPV1在皮肤组织酸化中的作用;然而,其他酸敏感离子通道(电压敏感河豚毒素抗性Na+通道;NaV1.8)或质子感应G蛋白偶联受体(T细胞死亡相关基因8;TDAG8)也不能排除。
药物拮抗剂、电针和艾灸对P2X3和P2X7受体介导的大鼠疼痛的影响
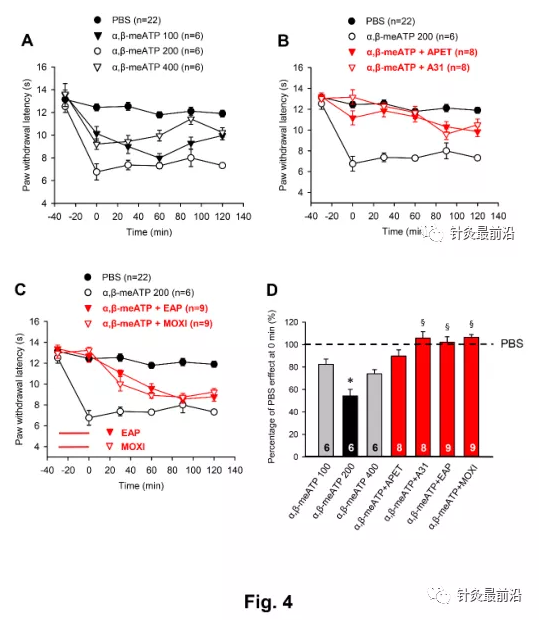
在通过注射酸性PBS对大鼠和小鼠进行测量后,我们发现由P2X1,3受体激动剂α,β-亚甲基ATP(α,β-meATP;图4)引起的急性疼痛超敏反应。α,β-meATP(100nM和200nM)引起PWL的剂量依赖性降低(图4A)。进一步增加α,β-meATP剂量至400nM不能诱导更多的抑制;因此,我们在随后的实验中使用200nM的嘌呤能激动剂。APETx2(20µM),A-317491(300 nM),EAP和艾灸引起α,β-meATP(200 NM)效应的同等抑制,尽管药理拮抗剂引起比AP家族更持久的PWL正常化(比较图4B和图4C)。出乎意料的是,不仅选择性P2X3受体阻断剂A-317491,而且ASIC3阻断剂APETx2被证明具有抑制性(另见图5)。所有发现都可以通过考虑正常PWL在0分钟时的百分比变化得到证实,如图4D所示。以百分比计算的200nMα,β-meATP的作用(54.3±5.7%;n=6;图4D)与pH6.0(62.8±4.8%;n=6)或pH4.0(67.7±4.8%;n=6;F=1.744,P>0.05;单因素方差分析)(图2D),在以前的实验中验证过。
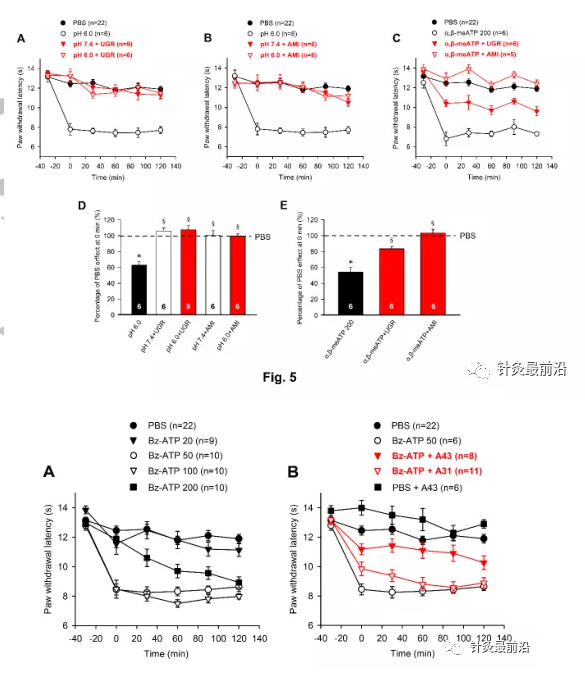
鉴于APETx2(20µM)可阻断pH6.0以及α,β-meATP诱导的热超敏反应,我们决定调查这是否是由于该特定的海洋毒素未能可靠地区分ASIC3和P2X3Rs,或者是ASIC3/P2X3同源受体是否在皮肤神经末梢起作用。我们认为后一种可能性很大,因为不仅是APETx2(20µM),而且还有另一种选择性ASIC3拮抗剂Ugr9-1(20µM)和一般的ENaC/DEG拮抗剂阿米洛利(10µM)。抑制了酸性pH和嘌呤能刺激引起的热敏反应(图5A-E)。值得注意的是,当注射到pH7.4PBS溶解的PAW中时,UGr9-1和阿米洛利都没有改变PWL(图5A,B)。
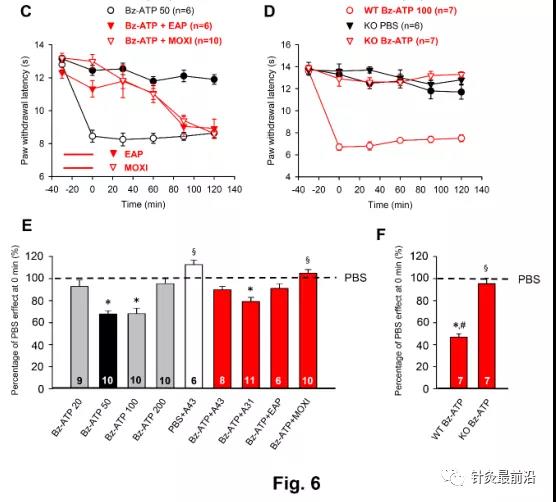
原型P2X7R激动剂二苯甲酰ATP(BZ-ATP)以非常明显的剂量-反应依赖性抑制PWL(图6)。BZ-ATP在20 nM时没有影响,而在50 nM时BZ-ATP的抑制已经达到最大值(图6A)。当BZ-ATP剂量从50 nM增加到100 nM时,PWL没有进一步降低。此外,BZ-ATP在200 nm处的作用小于BZ-ATP在100 nm处的作用,表明BZ-ATP具有钟形的量效关系。因此,我们在大鼠中使用50 nm的BZ-ATP进行所有连续测量。与选择性拮抗剂A-317491(P2X3R;300 nM)和A-438079(P2X7R;300 nM)的实验证明,只有P2X7Rs上的拮抗作用,而不是P2X3Rs上的拮抗作用,阻止BZ-ATP降低PWL(图6B)。此外,A-438079单独促进0分钟时间点的PWL,可能通过拮抗内源性ATP对P2X7R的紧张性抑制(图2)。图6B,E)。最终,EAP和艾灸以相同的效力和可比较的时间过程抑制BZ-ATP(50 NM)诱导的抑制(图6C)。所有发现都可以通过计算正常PWL 0分钟时的百分比变化得到证实,如图6e所示。通过检查这些数据,令人惊讶的是,尽管BZ-ATP的作用剂量低于α,β-meATP,但P2X7R在0min时的最大抑制作用小于P2X3R激活的情况(BZ-ATP50 nM,67.8±2.9%,n=10;α,β-meATP 2 0 0 nM,5 4.3±5.7%,n=6;P<0.0 5;学生t检验)。此外,BZ-ATP和α,β-meATP的剂量-效应曲线都显示出钟形模式(比较图6A与图6A)。4A)。
使用P2X7R KO动物提供了BZ-ATP在其相关剂量下刺激P2X7而不是P2X3R的额外论点(图6D,F)。很明显,BZ-ATP(100Nm)对P2X7R+/+小鼠有明显的作用,而对P2X7R-/-小鼠则完全没有影响。与经典的P2X7R KO小鼠不是完全的空等位基因,因为某些功能剪接变体避免失活,在我们使用的人源化P2X7R KO小鼠中,该受体完全失活。BZ-ATP(100 NM)用于小鼠,其对WT动物的抑制作用比大鼠最大有效剂量50 nM大得多。
药理拮抗剂、电针、艾灸对CFA诱导的大鼠炎性疼痛的影响
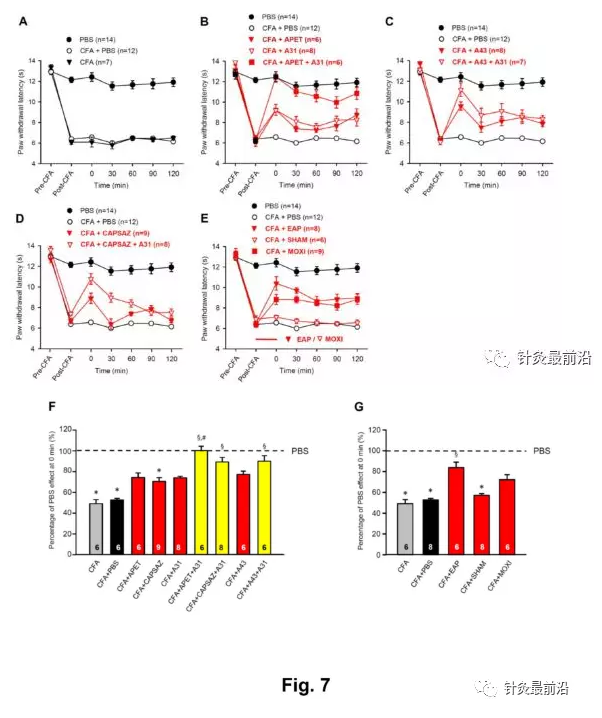
在上述实验中,我们发现EAP和艾灸逆转了由于在急性实验环境中将酸性PBS注射到大鼠或小鼠足爪中而导致的热超敏反应。这种效应被认为是由于ASIC3介导的伤害性感受在pH6.0而不是在pH 4.0时优先修饰所致。一般认为,升高的质子浓度可以在炎症组织中登记,并且炎症疼痛触发Autacoid的释放,如缓激肽、前列腺素、白细胞介素和生长因子(Julius&Basbaum,2001)。因此,在本实验中,CFA(100µl)注射到大鼠左后爪后24小时,对辐射热痛产生炎性超敏反应。
在图7中,我们总结了CFA处理的大鼠产生的实验数据。图7A显示,在应用CFA后24小时注射PBS并未改变热超敏反应的程度和时间过程。足底内应用APETx2(20µM)或A-317491(300nM)部分逆转了CFA引起的PWL下降,而这些拮抗剂的组合导致完全阻断(图7B)。注射选择性P2X7受体拮抗剂A-438079(300nM)也可抵消CFA的作用;A-438079(300nM)和A-317491(300nM)联合阻断P2X7和P2X3Rs的作用更大(图7C)。与单独应用两种激动剂相比,联合应用辣椒碱阻断TRPV1和A317491阻断P2X3Rs也引起更强的抑制作用(图7B,D)。此外,EAP和艾灸都增加了PWL的下降,而假EAP没有改变PWL(图7e)。
通过计算0分钟时正常PWL的百分比变化来确认先前的观察结果,如图7F,G。通过将APETx2与A-317491共同应用占据ASIC3和P2X3Rs,用辣椒碱加A317491阻断TRPV1和P2X3Rs两者,A-438079和A-317491共同应用占据P2X7和P2X3Rs,都消除了CFA引起的炎性疼痛(图7F)。EAP和艾灸,虽然可能比药理拮抗剂的程度小,但也抑制了这种疼痛方式(图7G)。同样明显的是,同侧假EAP不能单独改变CFA的效果。因此,可以得出结论,在我们的实验条件下,炎性疼痛是由许多pH和ATP敏感的伤害性感受器介导的,并且EAP/艾灸最有可能通过减少ASIC3(可能是TRPV1)通道以及P2X3/P2X7Rs介导的疼痛来引起镇痛。通过将A-317491与APETx2、Capsazepine或A-438079结合使用来消除CFA诱导的疼痛,表明所涉及的pH和ATP敏感伤害性感受器的刺激产生了超大效应。
结论
组织酸中毒和疼痛的发生之间似乎有直接的联系。急性皮肤疼痛伴随着组织pH的迅速下降,反之,皮下或肌肉内注射酸性盐水会导致啮齿动物和人类受试者发生局部疼痛。酸敏感的同源ASIC通道(ASIC1a,ASIC3),Trp通道(TRPV1,TRPA1),同源P2X3和P2X7Rs以及异构体P2X2/3Rs介导疼痛。
P2X受体通道对ATP从细胞内释放到细胞外空间的损害性释放作出反应。尽管低浓度ATP在酸性环境中同源P2X3Rs的影响降低,但高ATP浓度的影响通过低pH增强。对pH诱导的P2X受体敏感性的调制的直接比较表明,将pH从8.3移至6.3,在同源P2X1,P2X3,P2X4和P2X7Rs上,由ATP引起的DRG神经元中的电流幅度变小,但同时它们在同源P2X2Rs上增强。由于P2X2和P2X3亚基可能组装成异构体P2X2/3Rs,这种受体类型在与ATP和质子共刺激期间在介导酸性疼痛中获得重要意义。
正如已经指出的,很明显针灸可以缓解疼痛,但报道的实验证据相当不完整,缺乏系统的研究。已经得出结论,中等程度的质子积累(>pH 6.0)可能优先选通ASIC3,而大量积累的质子(<pH 6.0)似乎主要选通TRPV1。因此,ASIC3和TRPV1可能在感觉神经元的酸敏感性中具有互补作用。事实上,两种类型的通道的分布明显不同,在大鼠背根神经节(DRGs)中重叠不到50%。与这一假设完全一致的是,我们发现向大鼠脚掌注射pH6.0PBS通过主要刺激ASIC3降低PWL,因为APETx2对这种降低的抑制作用更明显,持续时间更长,而辣椒碱没有。相反,注射pH 4.0PBS引起的PWL降低主要刺激TRPV1,因为辣椒碱而不是APETx2阻断了热超敏反应。EAP和艾灸ST36穴位能减轻弱酸性PBS引起的疼痛,但不能减轻强酸性PBS引起的疼痛。
在炎性疼痛的大鼠CFA模型中,已证明选择性ASIC3拮抗剂APETx2可显著降低热和机械超敏反应。结论是包括ASIC在内的阿米洛利敏感通道在炎性疼痛的发展中起作用。我们在整个实验中必须使用相当高剂量的APETx2,超过了以前用于缓解啮齿动物爪子中酸诱导的炎症疼痛的APETx2(2.2µM,大鼠;1µM,小鼠)。然而,这些作者在向腓肠肌重复注射酸性溶液后用von Frey细丝测试触觉超敏反应,而我们将酸性PBS皮下注射到足爪中并测量温度超敏反应。反复肌肉注射pH为4.0的酸性介质会导致炎症性纤维肌痛,据报道对ST36穴位的EAP刺激敏感,但也对阿片和腺苷A1激动剂治疗敏感。将APETx2注射到野生型小鼠的爪子中或在ASIC3缺陷小鼠的实验中也可以抵消炎性疼痛。同样,针对ASIC3和EAP在ST36的miRNA都降低了在角叉菜胶诱导的爪子和/或肌肉炎症后的小鼠爪子中测量到的机械超敏反应。
实验表明,在TRPV1野生型小鼠的后爪注射弱酸性PBS(pH,6.0),EAP可消除热痛觉过敏的百分率变化,并可减少,但不能被艾灸消除。相比之下,在TRPV1基因缺陷小鼠中进行的类似程序导致通过EAP和艾灸完全阻断热超敏反应的百分比变化。我们认为TRPV1基因的缺失导致ASIC3敏感性的代偿性增加,从而增强了EAP/艾灸的ASIC3依赖性效应。根据这些结果,应用于ST36的EAP消除了CFA诱导的TRPV1-/-小鼠PWL的降低。
在炎症性疼痛模型中,我们发现在应用APETx2或辣椒碱后,热足超敏反应仅有中度降低。如上所述,ASIC3和TRPV1通道似乎以互补的方式一起工作以感知疼痛。CFA注射到鼠爪诱导的实验性纤维肌痛或炎性疼痛上调这两种通道类型的表达。在腰椎DRG和脊髓背角这一点通过免疫组织化学和Western blotting技术显示。应用于ST36的EAP不仅可以防止伤害性感受,而且还可以防止相应通道蛋白的增加。
与EAP对酸化引起的疼痛的影响相对有限的证据相比,关于EAP对嘌呤能机制引起的疼痛的影响有大量数据可用。有人认为,机械针刺和EAP从(亚)皮肤角质形成细胞和肥大细胞释放ATP,ATP本身或其酶降解产物腺苷是导致随后的镇痛效果的原因。鉴于A1Rs被证明介导针刺诱导的镇痛,我们建议P2X3,P2X2/3和P2X7Rs也可能在我们当前的实验中介导EAP的类似效果。值得注意的是使用手动针灸,每隔5分钟将插入ST36的针转30分钟,而我们使用EAP并持续电刺激同一穴位也30分钟。因此,我们的刺激程序比手工针灸更强大,因此,除了所涉及的A1R之外,上述P2XR也可能发挥作用。
我们证明P2X1,P2X3选择性激动剂α,β-meATP的作用引起的急性疼痛被选择性P2X3R拮抗剂A-317491改善。注射CFA引起的炎性疼痛也可以通过P2X3受体阻断和EAP/艾灸减轻,显然是由于炎症依赖性ATP的释放以及随后的P2X3和P2X2/3Rs的激活(本研究)。与这些发现一致的是,P2X3Rs在神经病理性疼痛中的参与以及EAP在这种疼痛状态下的有益作用已被反复证实。
已经发表的实验证据证明P2X7Rs参与神经病和颈部切口诱导的疼痛状态,但没有参与炎性疼痛。在本研究中,我们证明了足底内注射P2X1,3,7受体激动剂BZ-ATP引起的急性热超敏反应是由于P2X7的刺激而不是P2X1或P2X3Rs,因为高选择性P2X7R拮抗剂A-438079引起了完全的抑制。因此,A-317491和A-438079联合阻断P2X3和P2X7Rs几乎消除了CFA诱导的炎性疼痛。此外,A317491与APETx2或辣椒碱联合应用也强烈抑制CFA的作用。因此,ATP的伤害性释放可能激活P2X3和P2X7Rs,而质子的同时释放激活ASIC3/TRPV1;EAP和艾灸在较小程度上可能减轻通过刺激ASIC3/(TRPV1)和P2X3/P2X7受体引起的炎性疼痛。
总之,EAP/艾灸消除了急性和亚慢性炎症条件下低pH-和ATP诱导的疼痛。虽然这并不一定意味着酸和嘌呤敏感受体参与了这一效应,但介导这些疼痛状态的通道/受体数量有限,表明EAP/艾灸干预了ASIC3/P2X3和P2X7Rs的信号传导途径。
文章来源:Zhang, Y., et al., Acupuncture alleviates acid- and purine-induced pain in rodents. Br J Pharmacol, 2019.
