
 我要投稿
我要投稿
缺血再灌注引起的微循环障碍及其周围组织损伤常发生于冠心病溶栓或介入治疗 (Binder et al., 2015)、缺血性脑血管疾病溶栓 (Ginsberg, 2016)、挤压伤 (Odeh, 1991)、创伤和休克 (Gonzalez et al., 2015) 以及各种手术 (Schraag, 2016) 之后,可引发多脏器损伤 (Eltzschig et al., 2011),诱导脏器纤维化 (Rai et al., 2016) 和脏器功能衰竭 (Katseni et al., 2015)。防治缺血再灌注引起的微循环障碍和组织损伤具有重要的临床意义。
缺血再灌注引起的微循环障碍及其周围组织损伤包括缺血期、再灌注后的急性期、亚急性期和慢性损伤过程(图1)。缺血期间,由于闭锁或阻塞的血管末端缺血缺氧,线粒体呼吸链复合物V的亚单位三磷酸腺苷合成酶δ亚基(ATP5D)表达降低 (Lin et al., 2013; Tu et al., 2013; He et al., 2014; Li et al., 2014b),导致三磷酸腺苷 (adenosine triphosphate, ATP) 合成减少,加上血管及其周围组织消耗ATP,导致缺血末端的血管内和血管周围组织中的ATP严重缺乏 (Kalogeris et al., 2012)。ATP与细胞骨架高亲和,可以将单个的细胞骨架组装成肌动蛋白 (Pollard et al., 2003),维持血管内皮细胞间连接蛋白的排列,维持心肌细胞粗丝和细丝结构 (Harhaj et al., 2004)。但是,ATP降解为二磷酸腺苷 (adenosine diphosphate, ADP) 和5'-单磷酸腺苷 (adenosine monophosphate, AMP) 后,肌动蛋白脱落为单一细胞骨架,导致血管内皮细细胞连接蛋白磷酸化和排列紊乱,血管通透性发生变化 (Noll et al., 1995),心肌细胞粗丝和细丝降解,引发心功能的变化 (Chen et al., 2015a; Chen et al., 2015b)。同时,AMP的降解产物堆积和线粒体呼吸链的异常,为再灌注后过氧化物的产生提供了可能 (Bagheri et al., 2016)。当闭阻的血管因溶栓、扩血管、介入等治疗再通后,虽然氧气和营养物质的供应得以恢复,但另一方面又通过各种途径产生过多的过氧化物 (Eltzschig et al., 2011)。线粒体复合物I和II的低表达,一方面传递到复合物V的电子减少,不能提供足够的高能磷酸键供ATP合成酶将ADP转化成ATP,导致血运再通后,组织中的ATP持续地产生不足 (Kalogeris et al., 2012)。同时,堆积在线粒体复合物I和II中的电子可能从呼吸链中逸出,并与氧气结合,形成过氧化物 (Pell et al., 2016)。次黄嘌呤氧化酶,在氧气、水的参与下,催化缺血期间堆积的次黄嘌呤,释放活性氧(reactive oxygen species, ROS)(Meneshian et al., 2002)。过多的AMP激活腺苷酸活化蛋白激酶(AMP-activated protein kinase, AMPK)和蛋白激酶C(protein kinase C, PKC),诱导细胞浆内的还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate, NADPH)亚基p67和p47发生膜转位,而后膜亚基p91和NADPH氧化酶活化,爆发性地产生过氧化物 (Babior, 1999)。过氧化物一方面损害DNA、导致脂质过氧化、影响膜结构的完整 (Bagheri et al., 2016),同时,过氧化物还启动多种细胞内信号传导途径,引发炎性因子的释放、选择素和粘附分子的高表达 (Lefer, 1995; Lefer et al., 1996)。释放的炎性因子又通过细胞膜上的受体,进一步活化细胞内传导途径,引发细胞损伤 (Liu et al., 2016b)。白细胞和血管内皮细胞的选择素和粘附分子过表达引发白细胞沿血管壁的滚动和粘附 (Lefer, 1995; Lefer et al., 1996)。粘附在血管壁的白细胞释放蛋白酶和过氧化物,损伤血管内皮细胞间连接蛋白、血管内皮细胞和血管基底膜,增加血管通透性,引起血浆蛋白和红细胞的外漏 (Kumar et al., 2009; Rohrbach et al., 2015)。再灌注24小时内,游出到血管外的白细胞以CD11b和CD18阳性的多形核细胞为主 (Liu et al., 2016b),诱导了血管周围组织的急性炎性反应。血管外周的肥大细胞脱颗粒释放的炎性因子和血管活性物质 (Kalogeris et al., 2012),加重了血管的高通透性和血浆蛋白的外漏。暴露的血管基底膜促进了血小板粘附和血栓的形成 (Rohrbach et al., 2015)。再灌注后24小时至7日内,受损的血管内皮细胞和血管周围组织释放单核细胞趋化蛋白-1 (monocyte chemotactic protein 1, MCP-1) 和核糖体蛋白S19 (ribosomal protein, RP S19) 等趋化因子,趋化单核细胞游出于损伤的血管外,释放转化生长因子β1 (transforming growth factor-β1, TGF-β1),作用于成纤维细胞,通过Smad系统,诱导胶原沉积,启动了血管周围组织的重塑,导致器官的纤维化 (Wei et al., 2013b)。再灌注7日后,CD4阳性的淋巴细胞游出血管外,启动了血管周围慢性炎症过程 (Liu et al., 2016b)。
缺血 再灌注
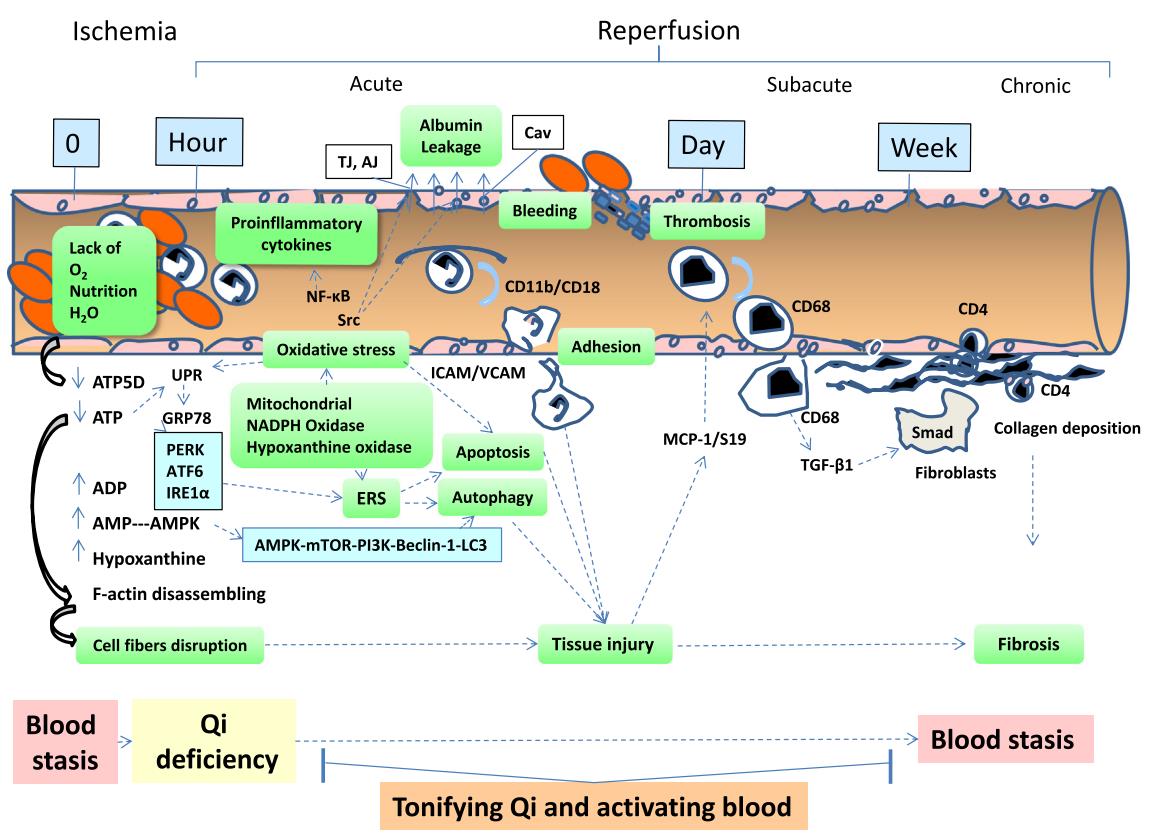
图1. 缺血再灌注引起的微循环障碍和器官损伤过程分为缺血阶段以及再灌注后的急性、亚急性和慢性阶段。对于缺血再灌注损伤的治疗,中药主要以补气或调气以及活血化瘀为主。
AJ, 粘附连接;AMPK, 腺苷酸活化蛋白激酶;ATF6, 活化转录因子6抗原;Cav, 质膜微囊;ERS, 内质网应激;GRP78, 葡萄糖调节蛋白78 ;ICAM, 细胞间粘附分子-1;IRE1α, 肌醇酶1α;LC3, 微管相关蛋白l轻链3;MCP-1, 单核细胞趋化因子1;mTOR, 哺乳动物雷帕霉素靶蛋白;PERK, 蛋白激酶样内质网激酶;PI3K, 磷脂酰肌醇-3激酶;RP S19. 核糖体蛋白S19 ;TGF-β1, 转化生长因子β1 ;TJ, 紧密连接;UPR, 未折叠蛋白反应;VCAM, 血管细胞粘附分子;虚线箭头: 诱发;↑, 增加;↓, 减少;⊥, 减弱
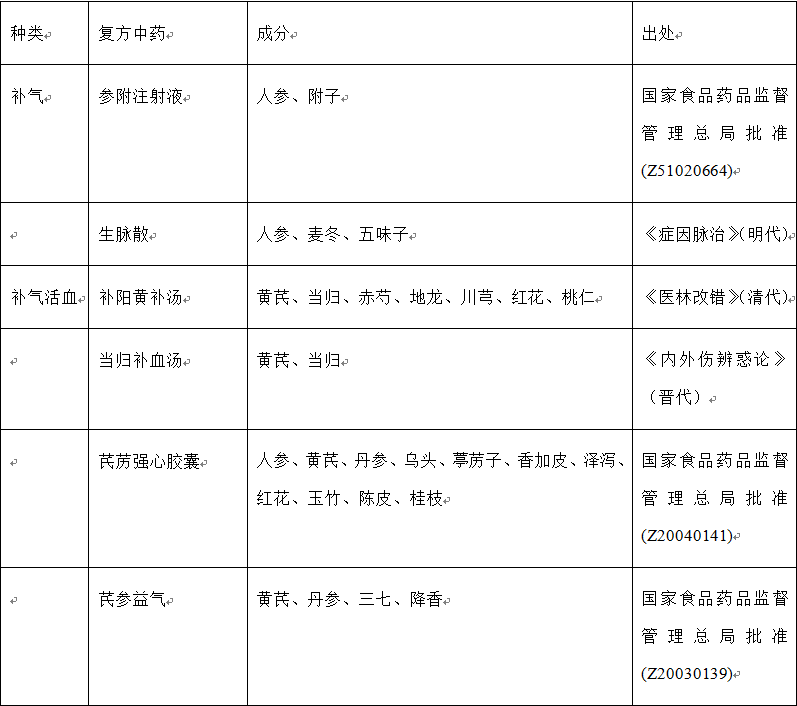
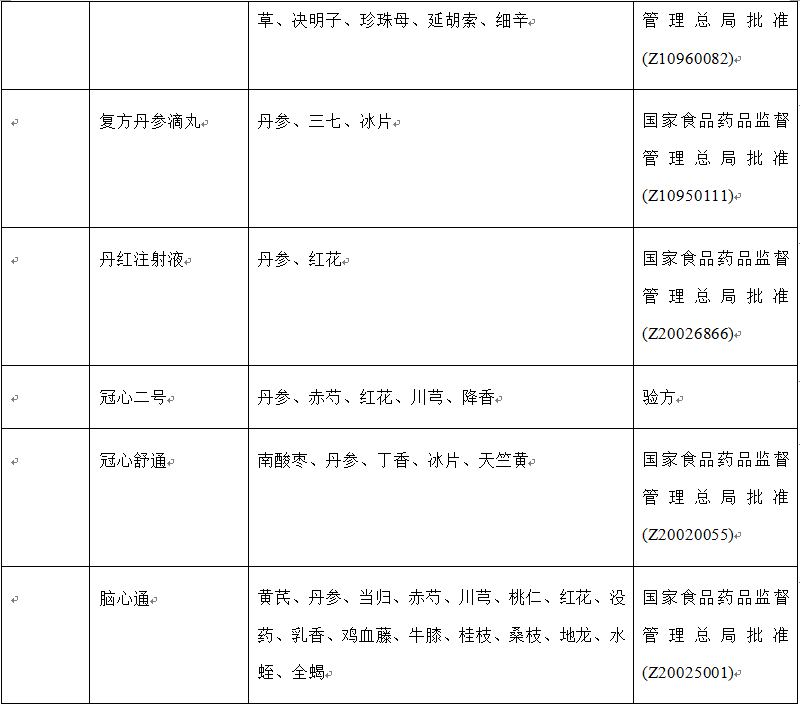
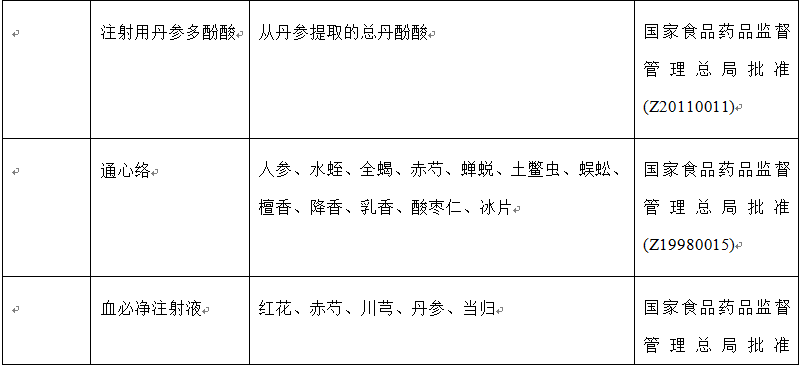
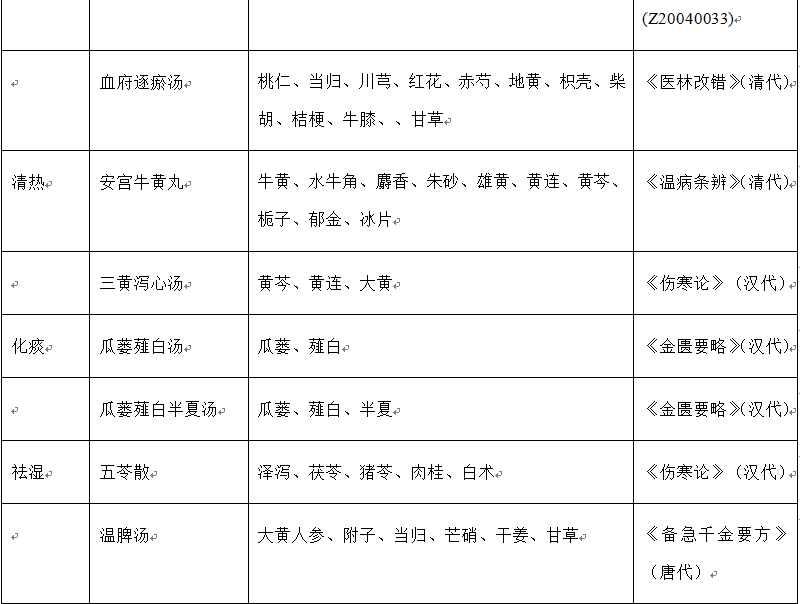
表1 复方中药的种类、名称、成分和出处

缺血再灌注引起的微循环障碍和器官损伤是复杂的病理过程,需要对其不同期间和不同环节进行多靶点的干预。目前临床使用的阿司匹林和罗比格雷,虽然,可以干预再灌注损伤的血小板粘附一个环节,但是,不能改善缺血再灌注引起的能量代谢异常、氧化应激损伤、白细胞与血管内皮的粘附、肥大细胞脱颗粒、炎性因子释放等环节,所以,其难以改善微循环障碍和脏器损伤。
中医药在中国已经有2千多年的临床应用历史,从唐代以后,传到了日本、韩国等亚洲国家。早在东汉末年的《伤寒论》中就记载了三黄泻心汤、瓜蒌薤白汤和瓜蒌薤白半夏汤等复方中药治疗胸痛。该部分内容在《金匮要略》中也有记载。金朝李东垣的《内外伤感辨惑论》(公元1247年)中记载了当归补血汤治疗气血两虚。清代,吴瑭的《温病条辨》(公元1798年)中记载了安宫牛黄丸治疗神昏。王清任的《医林改错》(公元1830年)中记载了补阳还五汤治疗中风、血府逐瘀汤治疗胸痛。
近30年来,随着生活方式的转变,心脑血管疾病在中国的发病率呈上升之势。为满足临床需要,一系列新型复方中药被研发出来,应用于临床,例如:(1)用于治疗心血管疾病的中药复方有:复方丹参滴丸、复方丹参片、冠心二号、冠心舒通、芪苈强心胶囊、芪参益气、生脉散和通心络等;(2)用于治疗脑血管疾病的中药复方有:养血清脑颗粒和脑心通等;(3)用于肾病:温脾汤和五苓散等。此外,一些注射液也用于治疗心脑血管疾病,例如丹红注射液、参附注射液、注射用丹参多酚酸、血必净注射液、血塞通注射液和益气复脉注射液。据报道,上述注射液能够缓解缺血再灌注诱发的微循环障碍以及心、脑和肾脏等器官损伤。表1列出了具有改善缺血再灌注损伤作用的复方中药的主要组成成分、刊出的年份和批准生产的年份。
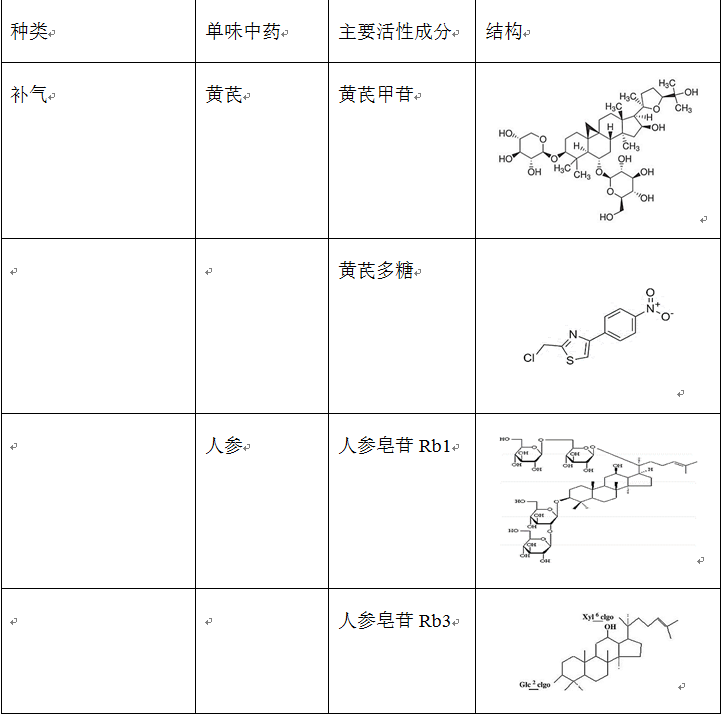
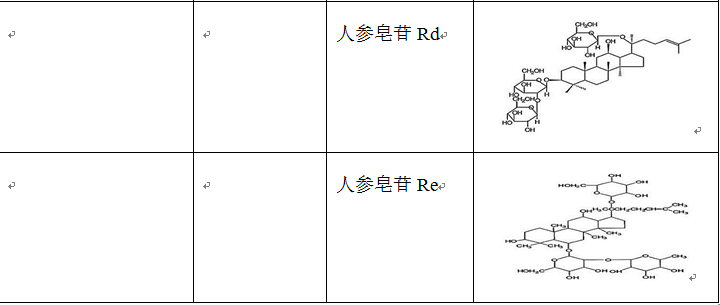
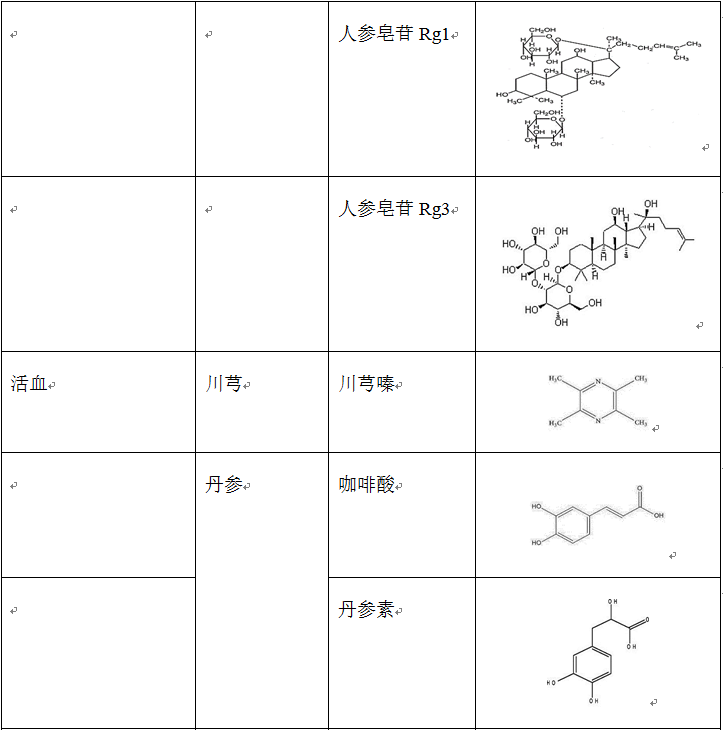
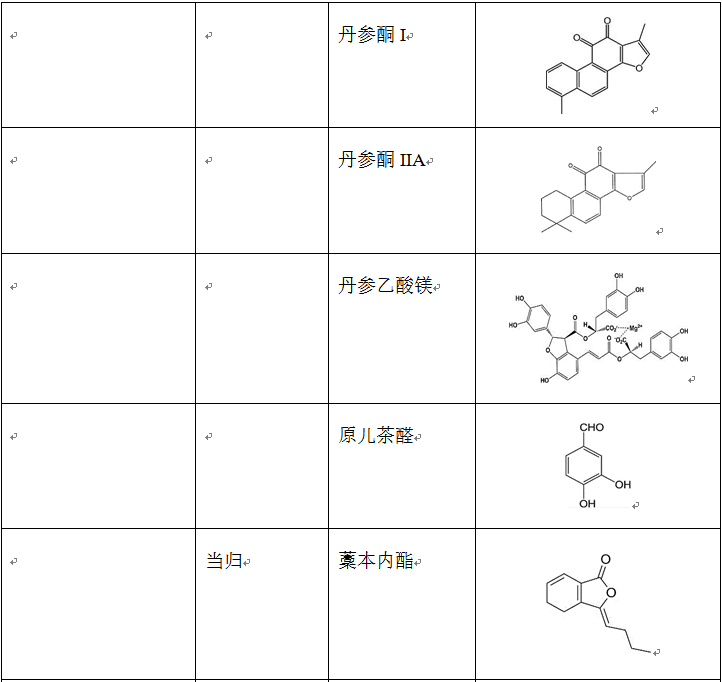
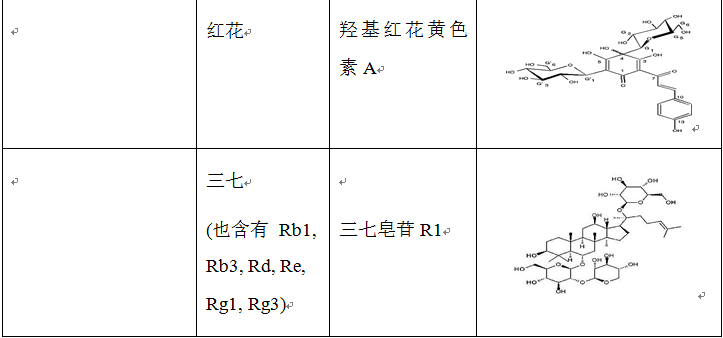
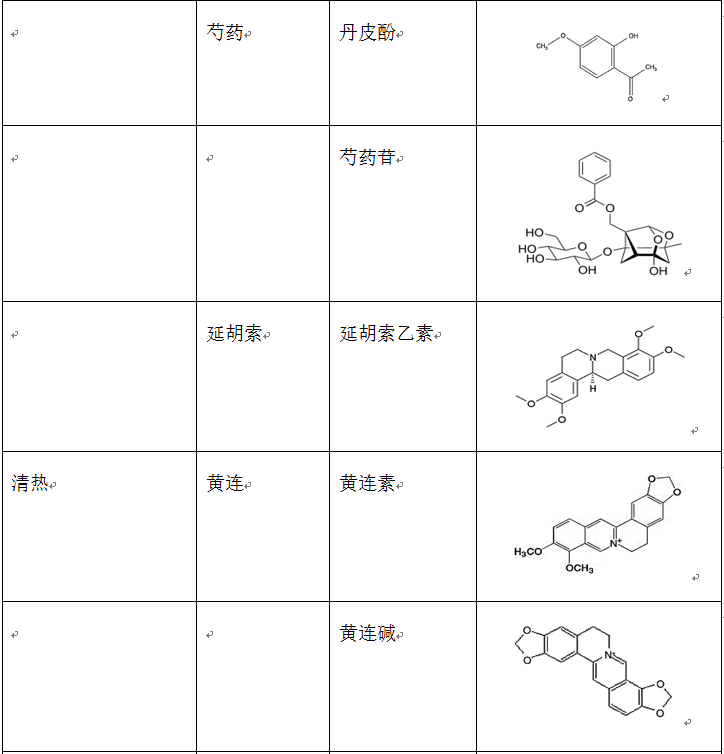
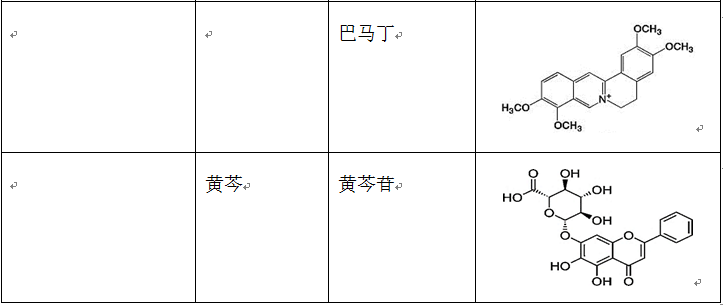
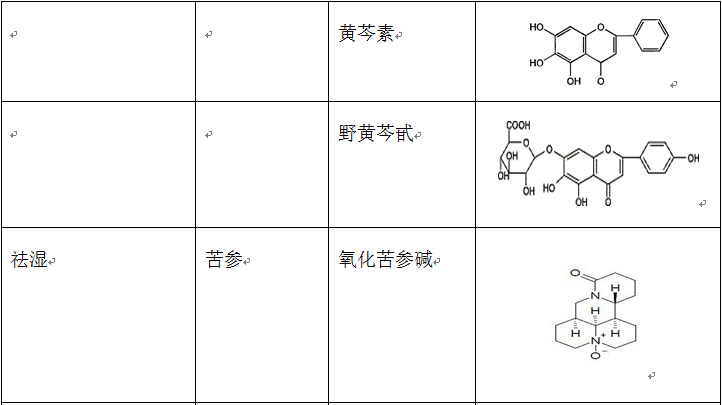
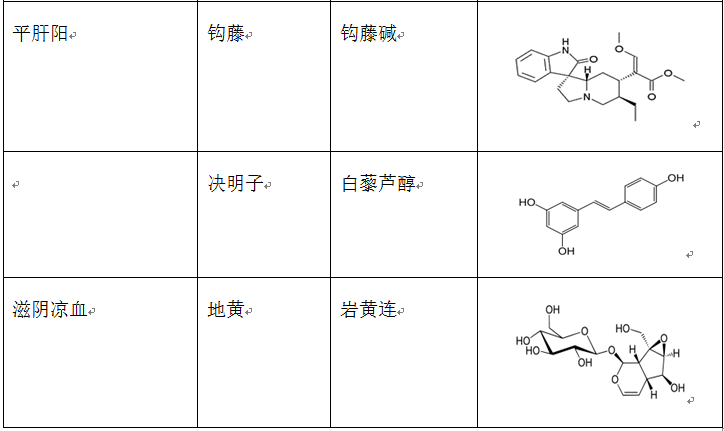
在治疗缺血再灌注损伤的复方中药中,使用频率较高的单味药包括活血药:丹参、三七、川芎、赤芍、红花、白芷、延胡索、白芍和当归等;补气药:黄芪、人参和冬虫夏草;清热药:黄连、黄芩和半枝莲等;祛湿药:苦参、银杏和苦瓜;平肝潜阳药:决明子和钩藤;滋阴凉血药:地黄。表2列出了上述单味中药主要的生物活性成分。
根据中医理论,气和血是缺血再灌注损伤的主要要素。气包括氧气和水谷精微,通过线粒体内的ATP合成酶生成ATP。ATP对肌动蛋白的聚合至关重要,肌动蛋白的聚合构成了肌肉细胞中的收缩结构,以及非肌细胞中微丝 (细胞骨架的一部分) 的组装。因此,对于心肌细胞发挥正常功能和保持血管内皮细胞之间的连接完整性来说,ATP必不可少。在心脏中,气可行血,促进血液循环。在血管中,气可摄血并维持体液平衡。缺血、缺氧、营养不良或ATP合成酶功能障碍均可导致气虚,从而引发血液循环紊乱,造成血瘀。其次,气虚可能导致微血管通透性增高,引发痰饮、水液停聚、水肿和出血。因此,对于缺血再灌注的治疗,复方中药和单味中药的主要用途是补气、调气以及活血化瘀(图1)。近年的研究证实了复方中药及其主要成分预给药,可以抑制缺血再灌注引起的心、脑、肝、肾、肠等脏器微循环障碍和组织损伤,在再灌注损伤发生后,对心、脑的微循环障碍和心肌纤维化也有改善作用,为缺血再灌注损伤的治疗带来了希望。我们于2008年系统地综述了丹参主要水溶性成份和主要脂溶性成分对缺血再灌注引起的心脏器微循环障碍和器官损伤的改善作用和机理 (Han et al., 2008; Han et al., 2009),在其后,又有大量丹参及其主要成分改善脏器微循环障碍的论文发表。我们在2015年综述了复方中药、单味中药和中药有效成分对缺血再灌注引起的脑微循环障碍和脑损伤的改善作用 (Sun et al., 2015)。为此,本文重点综述复方中药及其主要成分对缺血再灌注引起的脏器微循环障碍和组织损伤的改善作用,特别是主要成分的作用机理。
表2 单味中药主要生物活性成分的种类、结构和来源

除了心肌缺血再灌注损伤外,高血压等心脏负荷的增加也可能引发心肌纤维化、左心室重构,最终导致心力衰竭。芪参益气是一种著名的复方中药,在中国常规用于治疗心力衰竭。通过结扎冠状动脉左前降支诱发心力衰竭的动物模型,研究显示芪参益气治疗可发挥类似卡托普利的作用,通过抑制左前降支结扎诱导的基质金属蛋白酶 (matrix metalloproteinase, MMP) -2、MMP-9以及胶原蛋白I和III的升高,改善心肌重构 (Li et al., 2014a; Chen et al., 2015b; Wang et al., 2015b)。有意思的是,与芪参益气组成完全不同复方中药瓜蒌薤白汤,对左前降支结扎诱发的大鼠心肌纤维化也具有抑制作用 (Ding et al., 2013; Ding et al., 2016),但迄今为止对其所含有的生物活性成分尚未有研究。尽管如此,这些复方中药对缺血再灌注损伤诱发的心肌纤维化的有效性仍然有待验证,因为尽管最终的结果相同,但诱发的原因却不尽相同。
大脑只占身体重量的2%,但却消耗机体能量的20%,因此大脑对氧气和营养物质供应的变化高度敏感,以保障大脑血管的完整性和正常功能 (Pundik et al., 2012)。神经元对血液和细胞外液中离子成分的变化非常敏感;因此形成了脑部微血管独特的结构——血脑屏障。脑微血管中的内皮细胞具有独特的特征,在细胞之间有大量的紧密连接,而细胞质中的转运囊泡很少,这些特性对血脑屏障的形成贡献最大。此外,星形细胞也是血脑屏障的组成部分。神经胶质、神经元、微血管共同形成了神经血管单元,信号或物质在其中进行着双向传递 (Lo et al., 2003)。
脑缺血再灌注损伤引起微循环障碍,造成血脑屏障的破坏,从而导致包括脑水肿在内的一系列损伤和神经元死亡 (Huang et al., 2012; Wang et al., 2012a)。脑缺血再灌注后脑微循环的恢复对于防止进一步的脑损伤起着关键的作用 (Xu et al., 2009; Sun et al., 2010; Huang et al., 2012; Wang et al., 2012a)。在过去的几十年里,防止脑缺血再灌注引起的微循环障碍已经引起了越来越多的关注。目前,利用重组组织型纤溶酶原激活剂的溶栓疗法是西医用于急性脑中风治疗的主要手段,但血流量的恢复往往伴随着组织损伤的进一步恶化,特别是微循环 (Lo et al., 2003)。因而,能够有效改善微循环的中药业已成为一个很有吸引力的选择。
源自传统配方的复方中药养血清脑颗粒,由11种单味中药组成。1996年,国家食品药品监督管理总局批准用于治疗头痛和头晕等脑血管疾病。我们实验室通过对沙鼠和大鼠的实验研究证明,养血清脑颗粒具有减轻脑缺血再灌注引起的微循环障碍的作用。养血清脑颗粒预给药显著缓解了缺血再灌注引起的脑微血管中白细胞的粘附(养血清脑颗粒0.4 g/kg组、养血清脑颗粒0.8 g/kg组和缺血再灌注组分别为2.43 ± 0.24、2.28 ± 0.18和6.00 ± 0.35)、白蛋白的漏出(分别为2.51 ± 0.40、2.51 ± 0.40和4.77 ± 0.24)、脑微血管中二氢罗丹明123荧光强度的增加 (分别为16.35 ± 0.52、16.35 ± 0.52、21.46 ± 0.71),以及血管内皮细胞超微结构的改变和血管周围星形胶质细胞的肿胀。上述结果共同促进了脑血流量的恢复(养血清脑颗粒0.4 g/kg组、养血清脑颗粒0.8 g/kg组和缺血再灌注组分别为0.43 ± 0.07、0.43 ± 0.07和0.17 ± 0.08) (Xu et al., 2009; Wang et al., 2012a)。鉴于中风发生的不可预测性,在脑缺血再灌注损伤后再给予治疗将更具临床意义。令人感兴趣的是,养血清脑颗粒后给药对脑缺血再灌注引起的微循环障碍也具有改善作用。对沙鼠的研究显示,再灌注3小时后给予养血清脑颗粒(0.4 g/kg或0.8 g/kg)可以显著减少脑微血管中过氧化氢的产生、白细胞的粘附和白蛋白的漏出,同时减少了内皮表面的粗糙度和管腔内大量的表面突起以及内皮细胞指状突起。开放的小动脉和小静脉的数量增加,脑血流供应得以恢复 (Sun et al., 2010; Huang et al., 2012)。
补阳还五汤是这方面值得一提的另一复方中药。该方首载于清朝,在中国一直用于偏瘫等中风后遗症和脑血管疾病的治疗。对沙鼠脑缺血再灌注损伤进行的研究表明,补阳还五汤能够防止血脑屏障通透性的增加,改善皮层和海马的微血管结构,增加海马区和全脑的血流量,提示补阳还五汤对中风后遗症的有益作用可能归因于脑微循环的改善 (Zhao et al., 2010b)。多个已经发表的动物模型研究结果,不仅证实了补阳还五汤的有效性,而且探讨了其潜在的作用机制。有研究发现,在脑缺血再灌注大鼠模型中,补阳还五汤与骨髓间质干细胞移植联合使用,可以显著上调脑缺血一侧的血管内皮生长因子和Ki-67的表达,提示补阳还五汤可能通过上调血管内皮生长因子和Ki-67的表达促进受损微血管的修复 (Zhang et al., 2010b)。最近的一项对大鼠进行的研究进一步证实了补阳还五汤能够减轻缺血再灌注引起的脑损伤,并且提供了补阳还五汤可能影响血管再生的证据,表现为血清中血管内皮生长因子以及整合素α和β3含量增加,脑组织中血管内皮生长因子和CD34的表达增加 (Zhang et al., 2016b)。
已有研究表明,用于治疗脑血管疾病的注射用丹酚多酚酸在缓解缺血再灌注引起的脑微循环障碍方面也发挥了有益的作用。动物模型研究表明,注射用丹酚多酚酸通过AMPK/Akt/PKC信号通路抑制NADPH氧化酶的活化来防止缺血再灌注诱导的脑血管内皮细胞损伤 (Tang et al., 2014b)。
尽管上述复方中药中含有一些相同的单味中药,例如川芎和红花,但不同复方中的大多数药材彼此不同,更不用说每种药材中不计其数的活性物质了,因此每个复方中药中发挥作用的主要生物活性成分仍然有待确认。然而,有些生物活性成分已经得到了确认。例如,钩藤碱是钩藤的一种主要成分,已证明是体内和体外内皮素-1引起的脑动脉收缩的强效抑制剂 (Hao et al., 2014);延胡索乙素是从延胡索中提取的一种成分,已有研究报道,延胡索乙素能够增加紧密连接蛋白的表达,同时抑制caveolin-1和MMP-9的活化,从而保护缺血再灌注损伤的雄性C57BL/6小鼠的毛细血管,减轻血脑屏障损伤和脑水肿 (Mao et al., 2015)。
大脑代谢活动剧烈,因此极易受到缺血和/或再灌注损伤的影响。缺血引起的损伤特征是梗死区细胞由于缺乏氧气和营养物质供应而坏死。再灌注损伤涉及的损害源数量众多,其中ROS起着核心作用,它促进炎性反应并直接损害包括DNA在内的大分子,导致半影区或梗死周边区发生细胞凋亡。针对缺血再灌注损伤的治疗仍然面临着巨大的挑战 (Lo et al., 2003)。我们实验室的动物研究证实了养血清脑颗粒可以减轻缺血再灌注引起的神经元损伤。养血清脑颗粒预给药可以减小梗塞面积,提高神经学评分 (Wang et al., 2012a)。进一步的研究证实了养血清脑颗粒可以降低海马CA1区中末端脱氧核苷酸转移酶介导的缺口末端标记测定 (terminal deoxynucleotidyl transferase dUTP nick end labeling, TUNEL) 阳性细胞和半胱氨酸蛋白酶3 (caspase-3) 阳性细胞的数量,改善神经元的超微结构,防止神经细胞凋亡,保护神经元。此外,再灌注后给予养血清脑颗粒同样具有减轻神经元损伤的能力,表现为海马CA1区中神经元死亡减少 (Sun et al., 2010)。
补阳还五汤也被发现能够保护缺血再灌注引起的脑损伤。补阳还五汤灌胃给药可以减少大鼠神经功能缺损和脑梗塞面积 (Zhao et al., 2012; Jinglong et al., 2013)。令人感兴趣的是,一些研究报告表明补阳还五汤具有促进脑缺血后神经再生的潜力,表现为缺血大脑的海马、室管膜下区和皮层中血管内皮生长因子及其受体胎肝激酶的表达增加 (Cai et al., 2007);大鼠半影区中CD31和血管生成素-1的表达以及微血管的密度显著增加(补阳还五汤组,12.5 g/kg/d为51.00 ± 11.39,25.0 g/kg/d为77.00 ± 11.27;溶剂对照组17.73 ± 5.98,P < 0.01)(Shen et al., 2014);脑缺血再灌注大鼠脑缺血侧的血管内皮生长因子和Ki-67的表达上调 (Zhang et al., 2010b);缺血再灌注后,大鼠脑组织血管生成素miRNA和血管内皮生长因子的表达增加 (Yang et al., 2015a)。
缺血再灌注诱发脑损伤时,对神经元产生保护作用的其他复方中药包括通心络 (Yu et al., 2016c)和脑心通。脑心通为改进的一种复方中药,临床用于治疗急性和慢性脑血管疾病 (Liu et al., 2016c; Xue et al., 2016)。值得注意的是,通过小型动物正电子发射断层扫描成像研究显示,与对照组大鼠(23.9%)相比,脑缺血再灌注后第1周和第2周,通心络组大鼠缺血区的葡萄糖代谢明显增加,尼氏染色显示前额叶皮质的神经元丢失明显减少,神经学功能评分更高,脑梗死面积显著减小(10.3%,P <0.01),表明通心络具有治疗缺血再灌注引起的脑损伤的潜力 (Cheng et al., 2014)。
源自单味中药的许多生物活性成分在应对脑缺血再灌注损伤方面的作用也有大量的研究。其中,围绕黄芪、三七、人参和丹参的成分进行的研究最为广泛。研究证明了黄芪甲苷对脑缺血再灌注损伤具有有益作用,如减小梗死面积 (Luo et al., 2004)、改善神经功能、减小梗死面积 (Li et al., 2012) 和保护体外氧糖剥夺/再给氧造成的神经细胞损伤 (Gu et al., 2015)。人参皂苷是在人参中发现的甾类糖苷和三萜类皂苷,有40多种,其中具有减轻脑缺血再灌注损伤能力的包括:人参皂苷Rb1 (Gao et al., 2010; Lu et al., 2011; Zhu et al., 2012)、人参皂苷Rd (Ye et al., 2011; Hu et al., 2013; Liu et al., 2015c; Xie et al., 2016; Yang et al., 2016b)、人参皂苷Re (Zhou et al., 2006)、人参皂苷Rg1 (Xie et al., 2015; Yang et al., 2015c)、人参皂苷Rg3 (He et al., 2012; He et al., 2013)。多项研究探讨了三七总皂苷对局灶性脑缺血再灌注损伤的作用,结果显示三七总皂苷显著减少了TUNEL阳性细胞,降低了caspase-1和caspase-3的表达 (Li et al., 2009; Liang et al., 2009),减轻了缺血再灌注引起的脑损伤,改善了神经功能缺损评分并减小了梗死面积 (Zhang et al., 2012)。
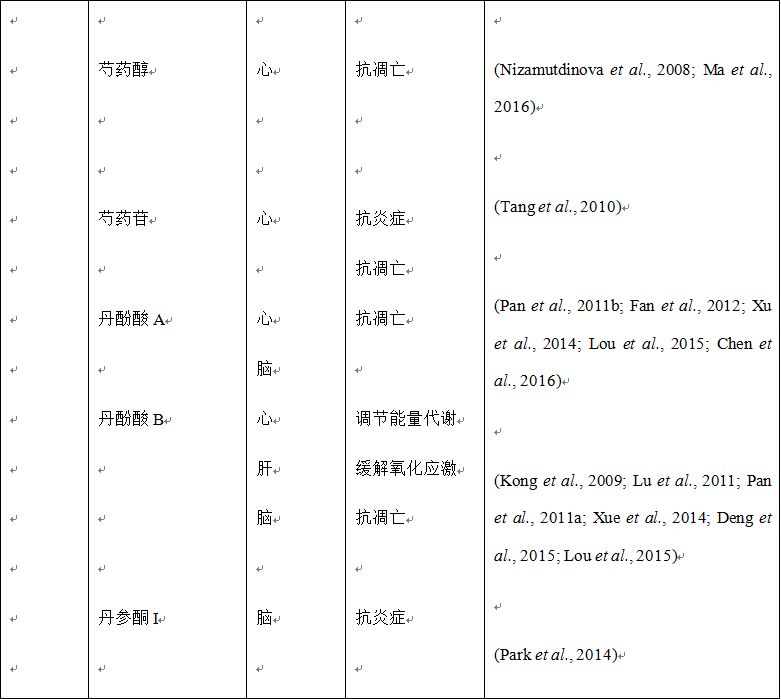
另一类在该领域引人关注的化合物是来源于丹参的活性成分,包括丹参酮I (Park et al., 2014) 和丹参酮IIA (Chen et al., 2012a; Chen et al., 2012b),均显示具有保护脑缺血再灌注损伤的能力。对于丹参中提取成分的生物活性研究可参考韩晶岩等人于2008年发表的综述文章 (Han et al., 2008)。此外,其他一些单味中药的活性成分也在保护脑缺血再灌注损伤方面进行了一定的研究,并取得了积极的结果(表4)。
关于单味中药生物活性成分对脑缺血再灌注损伤的作用研究中一个有趣的发现是:当不同来源的多个活性成分组合应用时,作用会得到显著的增强。例如,黄芪甲苷与人参皂苷Rg1、Rb1和R1合用 (Huang et al., 2014);黄芪甲苷与川芎嗪合用(神经功能评分:模型组为3.40 ± 0.52,黄芪甲苷治疗组为2.40 ± 0.51,黄芪甲苷+川芎嗪组为1.80 ± 0.42;梗死面积:模型组为0.315 ± 0.031,黄芪甲苷组为0.245 ± 0.022,黄芪甲苷+川芎嗪组为0.176 ± 0.014);三七总皂苷与黄芪提取物合用 (Huang et al., 2015a)。这一发现突出了复方中药相比于单一化合物的优势。
缺血性中风后发生的脑水肿有两种形式:血管源性和细胞毒性。中风后的细胞毒性水肿涉及星形胶质细胞肿胀和一些神经突的肿胀。这主要是由于氧气和葡萄糖缺乏导致脑细胞膜中的钠钙泵功能失调,细胞内的钠和钙急剧增加,造成细胞内的高渗透性导致了水的吸收和细胞的肿胀。此外,缺血再灌注损害了脑微血管床,导致血脑屏障的破坏和微血管的高通透性,使得血浆蛋白外流和水分在组织间隙的停聚,造成血管源性脑水肿。不管是何种形式,脑水肿是脑缺血再灌注的致命并发症,因为封闭的颅腔只能为脑组织提供有限的空间。因此,减轻脑缺血再灌注后的脑水肿已被视为一种拯救生命的疗法 (Lo et al., 2003)。
正如预期的那样,一些能够减轻缺血再灌注引起的微循环障碍的复方中药也可以防止缺血再灌注诱发的脑水肿。我们实验室的研究显示,养血清脑颗粒预给药能够保护缺血再灌注引起的血管周围水肿 (Xu et al., 2009; Wang et al., 2012a)。在再灌注3小时后给予养血清脑颗粒,可以减轻血管周围的星形胶质细胞肿胀 (Sun et al., 2010; Huang et al., 2012),这表明对于缺血再灌注引起的脑水肿,养血清脑颗粒是潜在的治疗选择。也有报道,脑心通可以改善脑缺血再灌注后脑的含水量 (Xue et al., 2016)。通心络前给药和后给药,连续3天,可以降低缺血再灌注后脑的含水量,下调水通道蛋白4的表达 (Liu et al., 2013)。此外,黄芪甲苷和三七总皂苷等生物活性成分对缺血再灌注后的脑水肿也具有保护作用 (Qu et al., 2009; Ning et al., 2012)。
肝脏微循环包含一个独特的毛细血管系统称为肝窦,排列成一种特殊的有窗内皮。具有很高的通透性,以保证肝细胞与血液最大限度的接触。大量证据显示肝脏微循环损伤是肝缺血再灌注损伤发展的主要事件 (Mu et al., 2015)。缺血再灌注引起的肝脏微循环障碍先于肝实质组织损伤的出现,包括微血管灌注不足导致的缺氧以及与再灌注有关的炎症反应,例如白细胞和枯氏细胞的激活和功能障碍(复流奇象)(Menger et al., 1999)。再灌注后肝窦的无复流现象被认为主要是由于肝窦内皮细胞的空泡形成和肿胀,以及缺血引起的能量缺乏、血管内血浓缩和内皮素与一氧化氮之间的平衡破坏所导致的肝窦腔狭窄 (Menger et al., 1999)。同时,复流导致了促炎细胞因子和氧自由基的释放、内皮细胞和白细胞粘附分子表达的上调以及白细胞与肝微血管内皮细胞的相互作用 (Menger et al., 1999; Ramalho et al., 2006)。
表4 单味中药的主要活性成分对缺血再灌注引起的器官损伤的影响
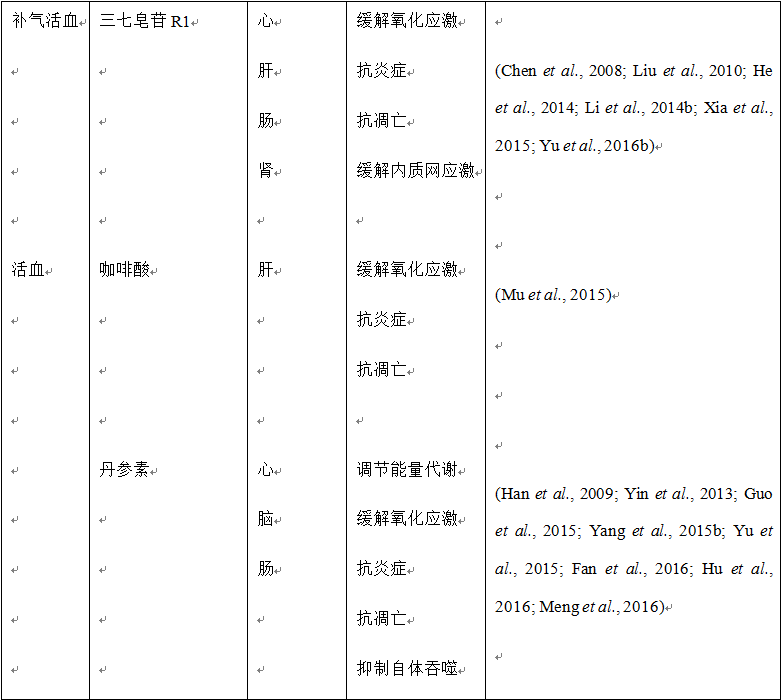
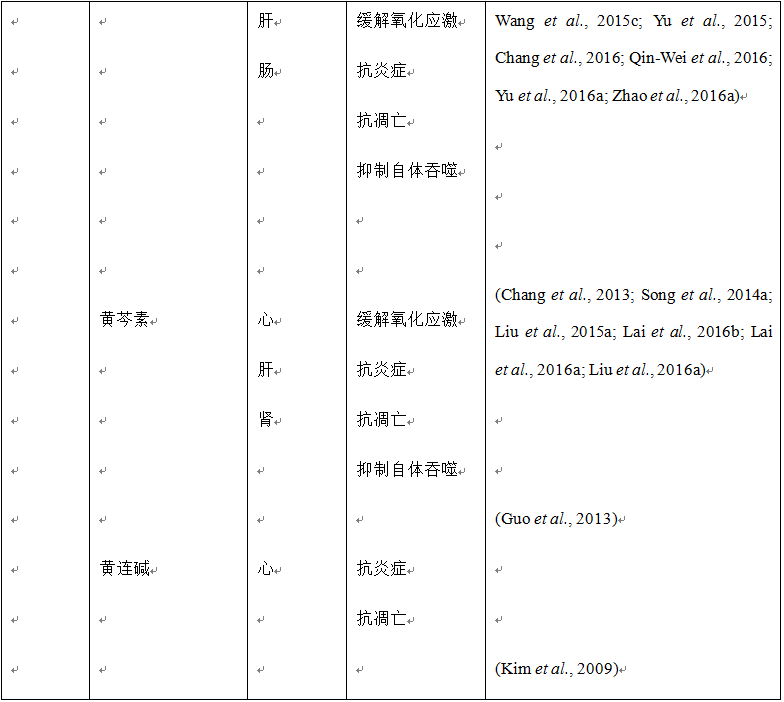
迄今为止,关于中药对缺血再灌注引起的肝脏微循环障碍的相关研究仅限于丹参和三七。通过配备有高速摄像机的活体显微成像系统,我们研究了咖啡酸(丹参富含的一种有机化合物,也广泛存在于多种植物)对肝脏缺血再灌注引起的大鼠微循环障碍的影响。结果表明咖啡酸能够显著缓解缺血再灌注引起的肝脏微循环障碍:减少肝终末门静脉和终末肝动脉中白细胞的滚动(假手术组2.42 ± 1.38,缺血再灌注组2.42 ± 1.75,咖啡酸+缺血再灌注组3.66 ± 1.51)和粘附(假手术组1.17 ± 1.16,缺血再灌注组1.17 ± 1.63,咖啡酸+缺血再灌注组2.66 ± 1.22);增加再灌注的肝窦数和肝终末门静脉和终末肝静脉内红细胞的流速(假手术组110.12 ± 5.87,缺血再灌注组65.84 ± 4.94,咖啡酸+缺血再灌注组107.04 ± 4.27)。此外,咖啡酸静脉给药有效防止了缺血再灌注引起的微血管灌注损伤 (Mu et al., 2015)。同样的,三七皂苷R1可以显著减轻肠系膜缺血再灌注引起的小鼠肝微循环障碍,包括减小的终末门微静脉和中心静脉的直径、红细胞在细静脉中的流速、再灌注的肝窦数以及增加的肝细静脉和肝窦中白细胞的滚动和粘附 (Chen et al., 2008)。复方丹参滴丸可以减少肠缺血再灌注引起的白细胞在肝小叶近中心区和终末肝细静脉肝窦中的瘀滞 (Horie et al., 2005)。此外,复方丹参滴丸还可以减轻长期服用乙醇的大鼠肝脏中加重的白细胞瘀滞。在一项大鼠肝移植实验中,丹参提取物减少了白细胞在肝窦和细静脉中的滚动和粘附,增加了血流量、红细胞流速、肝窦区毛细血管的直径以及移植体肝窦的灌注 (Liang et al., 2009)。
对于肝脏而言,缺血再灌注损伤可发生于肝外伤、肝内大肿瘤切除和肝移植等多种临床手术中。缺血再灌注后的肝损伤分为两个不同的阶段。初期(再灌注后2小时内)的特征是氧化应激,在此过程中,过量产生的ROS直接导致肝细胞损伤 (Ramalho et al., 2006)。补体的激活在缺血再灌注损伤的初期也发挥着重要的作用,而补体的耗竭可以减少枯氏细胞所引发的氧化应激 (Ramalho et al., 2006)。肝损伤的晚期发生于肝脏再灌注后6-48小时,主要表现为募集的中性粒细胞介导的炎性反应,至少部分通过ROS的释放进而损伤肝细胞。激活的中性粒细胞还释放弹性酶、组织蛋白酶G、乙酰肝素酶、胶原蛋白酶和水解酶,对肝细胞产生细胞毒性 (Ramalho et al., 2006)。肝缺血再灌注损伤的特征为肝窦血管收缩、中性粒细胞积聚、血小板聚集和毛细血管通透性改变,从而引起渐进性炎症反应,导致弥漫性细胞死亡和随之而来的急性器官衰竭。
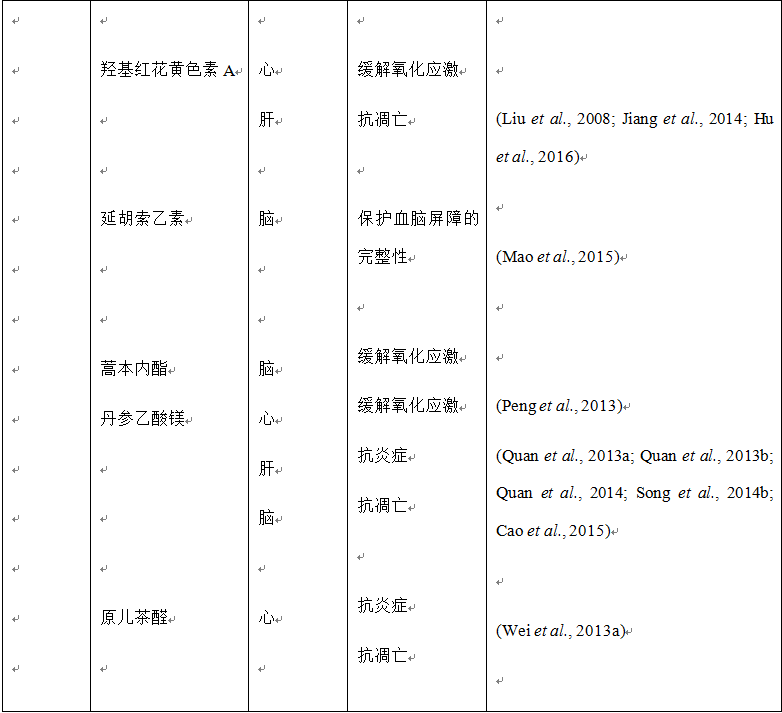
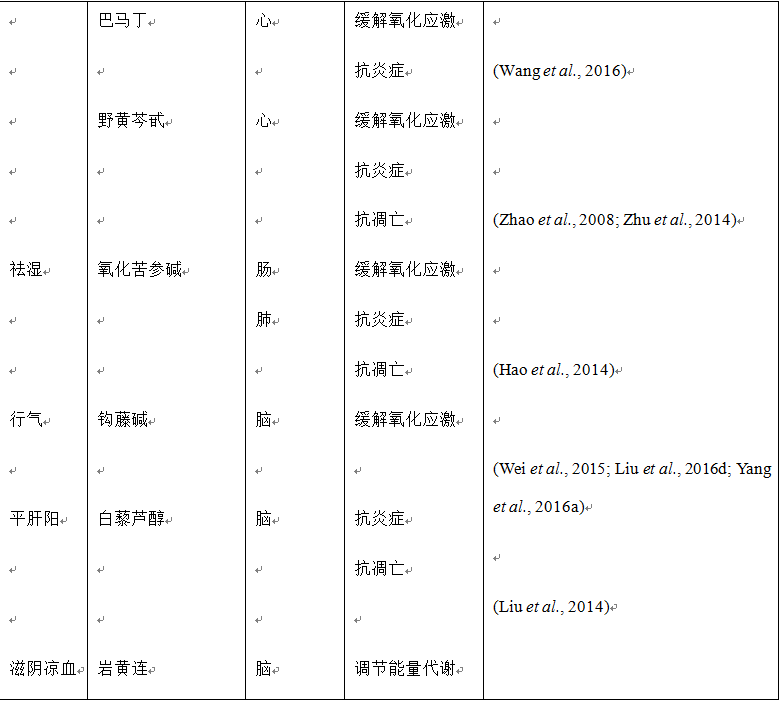
越来越多的证据表明复方中药、单味中药及其主要活性成分能够有效改善缺血再灌注引起的肝损伤。研究显示复方丹参滴丸能够减轻缺血再灌注诱发的肝损伤,抑制肠缺血再灌注引起的白细胞粘附于肝血窦,减少血清中内毒素和肿瘤坏死因子α (tumor necrosis factor-alpha, TNF-α) 的水平 (Horie et al., 2005)。血必净注射液在中国用于治疗严重的败血症,可以提高患者的生存率。据报道,血必净能够改善小鼠肝缺血再灌注损伤,表现为肝功能的改善、炎症的减轻、肝细胞凋亡的减少 (Liu et al., 2015b)。此外,血清学、组织学和生化检测等体内、外研究已证实多种单味中药和活性成分对肝缺血再灌注损伤具有保护作用,包括丹参提取物 (Xing et al., 2005; Liang et al., 2009)、人参总皂苷 (Fu et al., 2013)、黄芩素 (Liu et al., 2015a; Lai et al., 2016a; Liu et al., 2016a)、黄芩苷 (Kim et al., 2010; Kim et al., 2012)、黄连素 (Sheng et al., 2015)、咖啡酸 (Mu et al., 2015)、人参皂苷Rb1 (Wang et al., 2008a)、人参皂苷Rg1 (Tao et al., 2014)、羟基红花黄色素A (Jiang et al., 2014)、丹参乙酸镁 (Song et al., 2014b)、三七皂苷R1 (Chen et al., 2008)、丹酚酸B (Kong et al., 2009)、丹参酮IIA (Qi et al., 2012)。上述结果表明,尽管其他一些药材也需要关注,但对于肝缺血再灌注损伤,丹参和三七及其活性成分仍然是主要的有效治疗药物。
对临床医生来说,肝缺血再灌注损伤后的肝纤维化仍然是一大挑战,因为肝纤维化被认为涉及一系列的细胞和反应,包括星状细胞以及基质金属蛋白酶的激活 (Viappiani et al., 2006)。对肝缺血再灌注损伤动物模型的研究已经证明了基质金属蛋白酶抑制剂对缺血再灌注损伤后细胞外基质的重排具有保护作用 (Viappiani et al., 2006)。关于中药对缺血再灌注诱发的肝纤维化的影响,相关的研究很少,而且大多以中文发表。感兴趣的读者可参阅张等人的综述文章 (Zhang, 2002),这也是该研究方向唯一一篇英文文章。
微循环障碍是肠缺血再灌注损伤发生、发展的一个重要的决定因素。其特征包括营养灌注的缺失、炎性细胞反应和促炎介质激增、以及上皮屏障功能的破坏,伴随着细菌转位以及出现全身炎性反应 (Vollmar et al., 2011)。
我们的在体研究发现,丹参素预给药可以显著减少缺血再灌注后大鼠肠系膜毛细血管后细静脉壁中氧自由基的产生、白细胞的粘附以及白蛋白的漏出。有意思的是,在再灌注后10分钟给予丹参素,缺血再灌注引起的微循环障碍同样得到了改善,甚至减少了已经粘附于细静脉壁的白细胞数目 (Han et al., 2009)。在总丹酚酸的研究中,也获得了类似的结果 (Wang et al., 2010)。
我们利用肠缺血再灌注损伤的动物模型证明了三七主要成分三七皂苷R1对肠微循环障碍具有保护作用 (Li et al., 2014b),表现为在再灌注后40分钟和60分钟,三七皂苷R1前给药或后给药均可显著降低缺血再灌注引起的微血管通透性过高。与上述表现一致,三七皂苷R1可显著改善微循环灌注。缺血再灌注实验期间,三七皂苷R1并未显著改变血管的直径,表明三七皂苷R1对微血管通透性和血流量的影响并非微血管阻力变化的结果,而是内皮屏障的完整性得到了保护。胍流是一种含有丹参、三七和银杏的复方中药,对缺血再灌注引起的肠系膜微循环障碍也具有类似的效果 (Han et al., 2006)。
在内脏器官中,肠可能是对缺血再灌注损伤最为敏感的器官,从而造成了手术和创伤患者的高发病率和死亡率。缺血引起粘膜损伤,导致粘膜通透性增加,随后的再灌注加重了缺血诱发的组织损伤,表现为绒毛高度进行性缩短、绒毛上皮组织尤其是顶端缺失,以及主要位于小肠隐窝处的炎性细胞浸润 (Gu et al., 2013)。肠粘膜屏障的破坏可以导致肠道细菌和内毒素转位,从而引发炎性介质和细胞因子的释放,导致多种器官功能紊乱综合征,甚至是衰竭。
我们的研究证实了,三七皂苷R1能够显著减轻缺血再灌注引起的大鼠肠组织损伤,表现为肠组织宏观和显微组织学检测以及大鼠生存率的改善(再灌注后72小时,假手术组、缺血再灌注组、三七皂苷R1+缺血再灌注组和缺血再灌注+三七皂苷R1组分别为100%、30%、80%和60%)。此外,三七皂苷R1缓解了缺血再灌注引起的粘膜屏障的破坏、肠道的炎症和细胞凋亡 (Li et al., 2014b)。使用含有三七的血塞通注射液预给药同样有效缓解了肠系膜缺血再灌注损伤引起的大鼠肠屏障功能障碍,并且减轻了肠道的炎性水肿 (Xu et al., 2015)。另外,其他一些单味中药和主要生物活性成分,比如黄芪 (Chen et al., 2011)、黄连素、氧化苦参碱 (Zhao et al., 2008)和川芎嗪 (Toth et al., 2013),尽管作用机制可能各不相同,但都可以减轻缺血再灌注引起的肠组织损伤。
肾移植时,肾脏缺血再灌注损伤不可避免,这与移植排斥和功能障碍密切相关。肾脏缺血再灌注损伤的发病机制和应对策略与其他器官基本相同,但是,由于移植过程中摘除的器官内血液供应完全停止,此时的缺血再灌注可能引发一个不同于脑中风或心肌梗死的病理过程,从而使应对肾脏缺血再灌注损伤变得更为复杂。尽管如此,一些复方中药业已成为该种病理状况下的用药选择。
当归补血汤是最早试验用于治疗肾缺血再灌注损伤的复方中药之一。在中国,当归补血汤是一种治疗血液循环异常相关疾病的经典方剂,由黄芪和当归两种草药组成。通过夹闭双侧肾动脉阻断血流造成肾脏缺血再灌注损伤的动物模型研究发现,当归补血汤能够促进肾小球滤过率的恢复,增强缺血再灌注后肾血浆流动,防止少尿或缩短少尿期,降低钠的排泄分数并改善肾脏的组织形态损伤 (Cai et al., 2001)。
多种复方中药和生物活性成分已被报道具有抗肾脏缺血再灌注损伤的潜力,包括温脾汤加五苓散 (Seok et al., 2007; Seok et al., 2008)、冬虫夏草 (Wang et al., 2013a)、黄连 (Cho et al., 2004)、银杏 (Wang et al., 2008b)、川芎嗪 (Feng et al., 2004)、人参皂苷Rd (Ren et al., 2016)和人参皂苷R1 (Liu et al., 2010)。
肾纤维化发生在肾缺血再灌注损伤之后,是导致慢性肾功能衰竭的最常见原因。到目前为止,尚无有效的治疗方法来控制肾纤维化的发展,对该症具有潜在保护作用的复方中药报道的也很少。研究显示温脾汤配合五苓散可以减轻肾纤维化,其作用与减少氧化应激以及抑制ERK1/2、JNK1/2、p38和NF-κB的活化相关 (Seok et al., 2008)。
和其他器官一样,肺缺血再灌注损伤会激活血管内皮细胞,释放多种细胞粘附分子,促进中性粒细胞粘附和血小板聚集,从而导致微血管阻塞。与其他器官相比,由于敏感的肺表面和心脏跳动和换气导致的运动性伪影,使得肺微循环的研究更加困难。通过在体或离体标记法对循环细胞进行荧光染色可以实现在体可视化以及肺微循环不同部位细胞动力学和细胞之间相互作用的定量分析。但是,据我们所知,目前尚无这方面的直接证据。
外伤、动脉粥样硬化、肺栓塞以及心肺分流术和肺移植等手术都可能导致肺缺血再灌注损伤 (Ferrari et al., 2015)。对于缺血再灌注诱发的肺损伤,其特点是肺移植后72小时内出现非特异性肺泡损伤、肺水肿和低氧血症,更为严重的结果可能导致原发性移植失败,其仍然是肺移植后高发病率和死亡率的重要原因 (de Perrot et al., 2003; Pollard et al., 2003)。
一些复方中药的实验性研究已证明可以减轻缺血再灌注引起的肺损伤。参附注射液是含有人参皂苷和乌头碱等主要活性成分的一种复方中药。采用大鼠肺缺血再灌注损伤模型已证实,参附注射液能够减轻水肿、减少肺泡结构损伤、缓解肺损伤 (Zhang et al., 2016a)。在家兔左室缺血再灌注诱发的急性肺损伤模型中,血必净注射液治疗增加了氧分压,降低了二氧化碳分压,减轻了肺组织的水肿和充血,防止了缺血再灌注诱发的急性肺损伤 (Wang et al., 2016)。
一些活性成分也可以缓解缺血再灌注诱发的肺损伤。氧化苦参碱是从苦参中提取的一种化合物,研究显示能够对家兔肺缺血再灌注损伤产生保护作用,表现为减轻微血管内皮细胞损伤、改善血管通透性过高、提高抗炎和抗氧化能力,增强细胞膜的稳定性 (Zhu et al., 2014)。人参皂苷Rb1缺血后给药能够减轻肺组织形态损伤、缓解氧化应激引起的伤害、减少肺炎性细胞因子的释放,调节小鼠或大鼠肠缺血再灌注损伤后的炎症反应 (Wang et al., 2013b; Jiang et al., 2015)。
肺纤维化发生在肺组织受损时,包括缺血再灌注后的肺损伤。肺纤维化可能继发于充血性心力衰竭等其它病症。迄今为止,尚无复方中药对缺血再灌注诱发的肺纤维化具有保护作用的直接证据,尽管有报道显示芪苈强心胶囊改善了心肌梗死后大鼠的肺组织重塑 (He et al., 2015),但由于与缺血再灌注引起的肺纤维化的病因不同,因此,其对缺血再灌注引起的肺纤维化是否有效仍有待研究。
缺血再灌注损伤被广泛认为是一种复杂的病理状况,涉及到一系列由多种信号通路介导的损伤。越来越多的证据表明,复方中药和单味中药针对缺血再灌注损伤发病机制中的多重环节发挥作用,从而表现出了优于单一化学物质的优势。接下来,我们将就中医药在缺血再灌注损伤中发挥作用所涉及到的信号通路进行概述。
缺血造成的直接后果是氧气和营养物质的缺乏,导致能量代谢的紊乱,其表现为三羧酸循环明显下调,由此造成ATP严重缺乏和一系列能量依赖过程的功能障碍 (Murphy et al., 2008)。能量缺失使膜离子泵失效,导致钠、钙和氯流入细胞内以及钾的流出,升高了胞浆内的渗透压,激活了蛋白酶、磷脂酶和内切核酸酶,从而导致细胞结构完整性的破坏 (Murphy et al., 2008)。ATP严重缺乏导致F-actin的解聚,在心肌细胞导致收缩功能障碍,在内皮细胞则促使内皮屏障通透性过高 (Lin et al., 2013)。能量代谢受一系列因子的严格调控,其中去乙酰化酶(Sirtuin, Sirt)1是关键的参与者之一。缺血期间较低的葡萄糖水平引起烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide, NAD+)水平的增加,从而激活Sirt1 (Yang et al., 2015b)。Sirt1一旦激活,就会使转录辅激活因子PGC-1α去乙酰化,从而诱导线粒体和脂肪酸氧化相关基因的表达,维持细胞的生物能量状态。
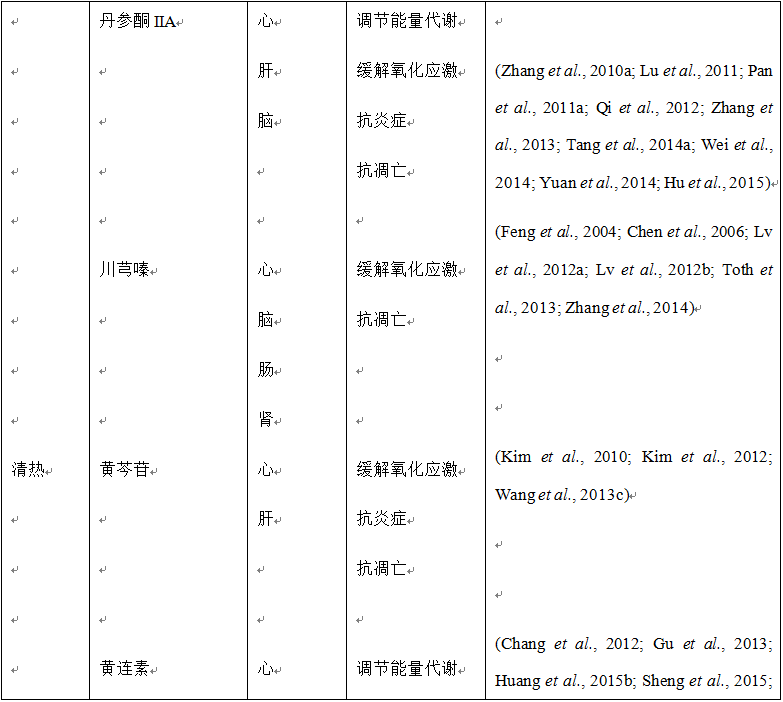
多种复方中药已被证明可以通过干预能量代谢来减轻心脏缺血再灌注损伤。我们以及其他团队的研究证据表明,缺血再灌注期间,ATP5D的下调有可能参与了ATP的消耗,芪参益气预给药有可能阻止上述情况发生。(Lin et al., 2013; Chen et al., 2015a)。我们的观察结果为这一结论提供了支持。在缺血30分钟和缺血30分钟再灌注90分钟时,ATP5D的蛋白和mRNA的表达量均显著减少。黄芪甲苷(芪参益气的主要成分之一)预给药显著增加了ATP5D的表达以及ATP/AMP和ATP/ADP的比值,恢复了能量代谢,减轻了缺血再灌注引起的心肌损伤,并且伴随着心脏功能的改善,表现为与缺血再灌注组相比,黄芪甲苷组的左心室舒张压和左心室舒张末压降低以及左心室内压最大上升速率增加 (Tu et al., 2013)。进一步研究发现三七皂苷R1预给药能够抑制ROCK的表达和活性,增加ATP5D的表达和ATP含量,减轻缺血再灌注后的心肌损伤和心肌功能障碍,表明ROCK信号介导了ATP5D的表达,并且参与了三七皂苷R1减轻ATP代谢紊乱的作用 (He et al., 2014)。与大鼠心脏研究结果一致,三七皂苷R1治疗也可以有效防止缺血再灌注后肠组织中ATP5D水平的降低 (Li et al., 2014b)。在另一项研究中,我们尝试确定复方丹参滴丸和芪参益气滴丸减轻缺血再灌注引起的能量代谢紊乱的作用机制。结果表明,丹参素(复方丹参滴丸和芪参益气滴丸中均含有的成分)可以防止缺血再灌注引起的复合物I的亚单位NADH脱氢酶(泛醌)1α亚单位10(NADH dehydrogenase (ubiquinone) 1 alpha subcomplex 10, NDUFA10)的表达减少,提高复合物I的活性和线粒体功能,并最终改善缺血再灌注后的心脏结构和功能损伤,其作用可能与其结合并激活Sirt1的能力有关 (Yang et al., 2015b)。应用代谢组学的研究方法 (Xin et al., 2013; Zou et al., 2015)也发现复方丹参滴丸能够通过调节心肌缺血损伤的能量代谢、糖酵解和脂质代谢来发挥对大鼠心肌缺血的治疗作用。另外一项研究采用基于核磁共振氢谱(1H NMR)的代谢组学方法结合多变量数据分析研究了芪参益气在心肌缺血二级预防中的作用机制。结果表明,芪参益气可以调节代谢紊乱并促进代谢表型回归到接近正常范围 (Chen et al., 2016)。类似的,复方丹参片也可以在一定程度上通过调节心肌能量代谢紊乱发挥对心肌缺血的保护作用 (Lv et al., 2010; Zhan et al., 2015)。蛋白质组学分析发现生脉散治疗能够调节缺血再灌注损伤大鼠心肌能量代谢的多条通路,包括刺激葡萄糖代谢,抑制脂质代谢以及增强三羧酸循环和ATP合成,这些均有利于能量的生成和心脏效率的提高 (Zhan et al., 2015)。丹酚酸、三七总皂苷以及两者联用对心脏缺血再灌注损伤也具有类似的作用 (Yue et al., 2012)。
另外,有研究发现某些单味中药能够通过调节能量依赖过程,尤其是离子泵,来防止缺血再灌注损伤。例如,丹参 (Qiao et al., 2011; Song et al., 2013; Ge et al., 2014) 和丹参酮IIA (Wei et al., 2014) 能够增强缺血再灌注大鼠的心肌Na+/K+-ATPase和Ca2+-Mg2+-ATPase的活性,抑制Ca2+内流,降低心肌细胞和线粒体中的Ca2+的含量,减轻钙超载。在体心肌梗死动物模型研究也发现,丹参的两种活性成分丹酚酸B和丹参酮IIA能够通过调节与一氧化氮产生相关的多个靶点发挥心脏保护作用,例如,通过增加阳离子氨基酸转运蛋白的表达刺激L-精氨酸的摄取以及通过AMPK/PI3K/Akt通路增强eNOS的表达和磷酸化 (Pan et al., 2011a)。鉴于AMPK在调节能量代谢中的重要作用,因此调节能量代谢在这些药物作用的发挥方面是显而易见的。
氧化应激是缺血再灌注损伤的关键因素。细胞内的ROS来自多个渠道,包括线粒体呼吸链、黄嘌呤氧化还原酶、NADPH氧化酶、一氧化氮合成酶、环加氧酶和脂氧合酶 (Bagheri et al., 2016)。在生理状态下,细胞内存在的氧自由基和氧化物处于较低水平,它们参与调节细胞稳态、有丝分裂、分化以及信号传导。然而,缺血再灌注时,ROS的生成显著增加,就会通过多种通路损害细胞。尽管哺乳动物细胞中存在着内源性的自由基清除酶,如超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶(catalase, CAT)和谷胱甘肽过氧化物酶(glutathione peroxidase, GPx),但是这些抗氧化防御措施仍然不足以应对缺血再灌注后的ROS含量激增。因此,缓解氧化应激是应对缺血再灌注损伤的一种有效策略,也是许多复方中药和单味中药改善缺血再灌注损伤的作用基础。
线粒体复合物I和III是再灌注期间ROS产生的主要来源。最近有研究表明,sirtuin家族蛋白,即NAD+依赖型去乙酰酶可以控制复合物I和II的表达和功能,因此是氧化应激重要的调节剂 (Lombard et al., 2007; Ahn et al., 2008)。
丹参素(复方丹参滴丸的主要成分之一)是一种众所周知的抗氧化剂。我们的实验研究表明,丹参素通过调控线粒体结构和功能发挥抗氧化作用。丹参素能够结合Sirt1,从而在心肌缺血再灌注后恢复NDUFA10的表达和复合物I的活性,最终缓解氧化应激,减少梗死面积,改善心肌血流量,减小收缩末期的左心室内径和容积,提高左心室射血分数、左心室缩短分数和左心室面积变化分数 (Yang et al., 2015b)。在另一项研究中,我们发现,咖啡酸(复方丹参滴丸中丹参的单酚酸化合物)可以促进Sirt3(另一种NAD+依赖型去乙酰化酶)的表达和活性 (Lombard et al., 2007; Ahn et al., 2008),防止NDUFA9和琥珀酸脱氢酶复合物亚基A的乙酰化,从而改善了线粒体呼吸链复合物的活性,缓解了缺血再灌注后肝脏的氧化应激损伤 (Mu et al., 2015)。此外,有报道表明黄连素(从黄连中分离出来的异喹啉衍生物生物碱)也可以保护线粒体复合物I的活性 (Wang et al., 2015c)。
NADPH氧化酶存在于专职吞噬细胞中,在缺血再灌注后的ROS产生中起关键作用。NADPH氧化酶是一种由两个膜结合组分(gp91phox和p22phox)、三个胞浆组分(p67phox、p47phox和p40phox)以及低分子量G蛋白(Rac2或Rac1)组成的复合物 (Babior, 1999)。NADPH氧化酶的激活需要胞浆组分和调节亚单位(包括p67phox, p47phox, 和p40phox)之间的相互作用,形成一种酶复合物,进而转位至细胞膜并与之融合,随后将单个电子从胞浆的NADPH转移到细胞外分子氧,产生超氧化物 (Bedard et al., 2007)。
我们的研究发现,采用复方丹参滴丸治疗能够保护大鼠心脏免受缺血再灌注诱发的种种影响,包括梗死、凋亡、微循环障碍、氧化应激和炎性反应;同时,能够抑制缺血再灌注诱发的NADPH氧化酶亚基gp91phox的表达以及p67phox和p47phox从细胞质到细胞膜的转位,表明复方丹参滴丸对心脏的保护作用至少在一定程度上与其抑制NADPH氧化酶活化的抗氧化活性相关 (Yang et al., 2013)。注射用丹参多酚酸能够抑制NADPH氧化酶亚基gp91phox的表达以及p67phox和p47phox从细胞质到细胞膜的转位,减轻缺血再灌注诱发的大鼠脑损伤 (Tang et al., 2014a; Chen et al., 2015a)。此外,有报道表明芪参益气 (Li et al., 2014a; Chen et al., 2015a)和黄连素 (Yu et al., 2016a; Zhao et al., 2016a) 能够通过减少NADPH氧化酶、NOX基因或gp91phox的表达来抑制心肌缺血再灌注引起的氧化应激和ROS的生成,从而有助于减轻缺血再灌注损伤。
缺血再灌注后,黄嘌呤氧化酶依赖的超氧化物的生成也会导致器官损伤。缺血将黄嘌呤脱氢酶转化为黄嘌呤氧化酶,后者随后将次黄嘌呤转化为黄嘌呤,并进一步催化黄嘌呤氧化成尿酸,这两个反应均导致ROS的生成 (Meneshian et al., 2002)。
关于复方中药通过调节黄嘌呤氧化酶减轻缺血再灌注诱发的氧化应激方面的研究目前为止非常有限。仅有的一篇已发表的论文显示,芪苈强心胶囊给药28天显著减轻了心肌梗死引起的左心室扩张,降低了大鼠心脏非梗死区域心肌组织的黄嘌呤氧化酶活性,增强了O2−和·OH清除活性,表明芪苈强心胶囊能够减少非梗死区ROS的生成并防止左心室的重构 (Xiao et al., 2015)。
研究发现许多中药可以直接调节内源性的自由基清除剂,从而在缺血再灌注损伤时发挥产生抗氧化作用。例如,复方丹参片 (Ren-an et al., 2014) 和丹红注射液 (Guan et al., 2013) 可以增加SOD的水平,从而减弱缺血再灌注诱发的氧化应激。复方丹参滴丸 (Yang et al., 2013) 可以提高缺血再灌注模型动物谷胱甘肽的水平。芪参益气 (Chen et al., 2015a) 能够增加大鼠心肌组织中SOD和CAT mRNA的表达,从而显著抑制缺血再灌注诱发的氧化应激和ROS的产生。由于上述制剂中的成分截然不同,因此,其增强自由基清除的具体成分仍需进一步的研究。值得注意的是,丹参中的许多成分,如咖啡酸 (Mu et al., 2015),丹参素 (Han et al., 2009; Yu et al., 2015; Hu et al., 2016)、丹参乙酸镁 (Quan et al., 2013b)、丹酚酸A (Fan et al., 2012)、丹酚酸B (Kong et al., 2009; Xue et al., 2014) 和丹参酮IIA (Qi et al., 2012; Wei et al., 2014; Hu et al., 2015),均已被证实能够调节某些内源性抗氧化剂的水平,从而抑制氧化损伤并增强缺血再灌注期间的抗氧化防御能力。
炎症是缺血再灌注损伤发展中的一个主要阶段,涉及先天免疫系统和适应性免疫系统以及补体系统的激活,其特征是免疫细胞的募集和浸润以及ROS、促炎因子、细胞因子和趋化因子的释放 (Liu et al., 2016b)。缺血再灌注诱发的炎症参与了导致实质细胞的损伤和修复 (Liu et al., 2016b),是缺血再灌注损伤治疗的一个重要靶点。
越来越多的证据表明控制炎症反应参与了复方中药和主要生物活性成分对于缺血再灌注损伤的保护作用。我们的研究发现,复方丹参滴丸后给药(0.8g/kg)显著减轻了心肌缺血再灌注引起的中性粒细胞和单核细胞的浸润,同时提升了左心室收缩压和左心室最大上升速率,并且降低了左心室舒张末压、左心室舒张压和左心室最大下降速率 (Wei et al., 2013b)。类似的作用也出现于三七皂苷R1(复方丹参滴丸的主要成分之一),它能够防止缺血再灌注引起的中性粒细胞和单核细胞在小肠的募集,降低髓过氧化物酶的活性 (Li et al., 2014b)。咖啡酸预给药可以缓解缺血再灌注引起的肝门静脉末端细静脉、终末肝细静脉和肝窦内白细胞的募集 (Mu et al., 2015)。研究还发现其他一些复方中药、单味中药和主要生物活性成分也能够减少缺血再灌注引起的白细胞募集,如血必净注射液 (Liu et al., 2015b),黄连素 (Yu et al., 2016a),丹参素 (Yang et al., 2015b),人参皂苷Rb1 (Wang et al., 2013b),羟基红花黄色素A (Jiang et al., 2014),丹参乙酸镁 (Guan et al., 2013; Quan et al., 2013a; Quan et al., 2013b; Song et al., 2014b),三七皂苷R1 (Xia et al., 2015) 和丹参酮IIA (Zhang et al., 2010a)。此外,大量复方中药、单味中药和主要生物活性成分通过抑制炎性介质的产生来减轻缺血再灌注损伤(表5)。
Toll样受体(Toll-like receptors, TLR)参与了缺血再灌注引起的炎症反应。缺血再灌注期间产生的内源性配体,例如凋亡的细胞碎片、纤维蛋白原、高迁移率族蛋白B1 (high-mobility group box 1 protein, HMGB1)和热休克蛋白等,与TLR结合,导致下游信号通路,包括NF-κB、丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)和I型干扰素等通路的激活。NF-κB的活化能够促进促炎细胞因子、趋化因子和粘附分子的表达,而MAPK信号通路则激活以细胞因子基因为靶点的转录因子复合物 (Eltzschig et al., 2011)。此外,TLR7和TLR9信号传导也通过TIR结构域接头分子依赖型通路介导了I型干扰素的生成。已有文章详细阐述了TLR介导的NF-κB活化和炎症反应在缺血再灌注损伤中的重要性 (Tacke et al., 2009; Eltzschig et al., 2011; Ha et al., 2011),控制NF-κB的活化是减少损害性组织损伤的潜在治疗策略 (Eltzschig et al., 2011)。
许多复方中药、单味中药以及主要生物活性成分均已被发现能够抑制缺血再灌注引起的NF-κB通路的活化(表6)。例如,我们观察到复方丹参滴丸可以抑制心脏缺血再灌注损伤后IκB-ɑ的降解,表明NF-κB通路参与了复方丹参滴丸的治疗作用 (Zhao et al., 2010a)。黄芩苷(黄芩根部分离的主要活性成分)通过抑制TLR4介导的炎症信号通路对酒精性脂肪肝缺血后的损伤发挥了保护作用,其表现为TLR4和骨髓分化因子88蛋白的表达下调以及再灌注后NF-κB的核转位减少 (Kim et al., 2012)。丹参乙酸镁能够通过NF-κB和MAPK通路,阻止炎症信号通路的激活,从而减轻缺血再灌注引起的肝细胞损伤和肝细胞凋亡 (Song et al., 2014b)。
表5 复方中药、单味中药和主要活性成分对缺血再灌注诱导的炎性介质释放的影响
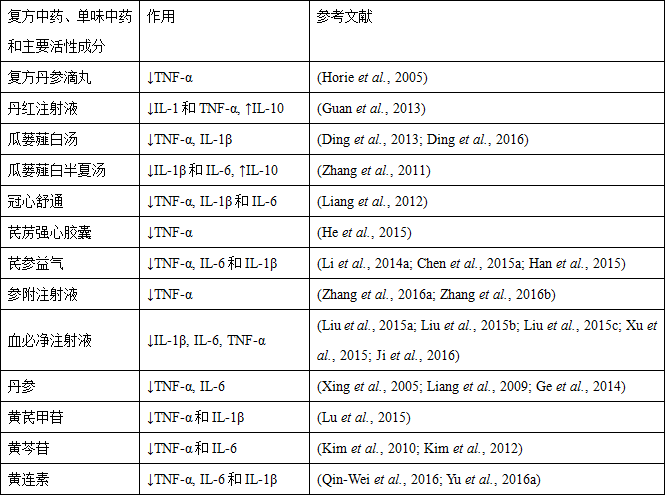
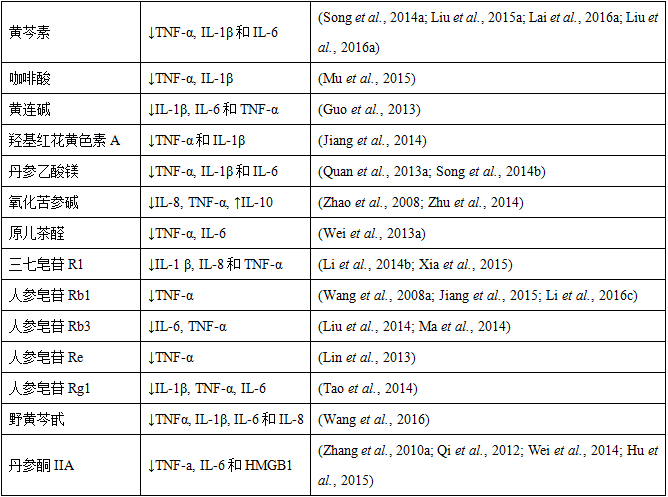
缺血再灌注后,释放的氧自由基、细胞因子和其它促炎介质能够同时激活中性粒细胞和血管内皮,促进粘附分子的表达,导致白细胞粘附于血管内皮和跨内皮迁移 (Lefer et al., 1996)。目前已经确认三个细胞粘附分子家族能够调节白细胞和内皮细胞的相互作用:(a) 选择素(即P-选择素、L-选择素和E-选择素);(b) β2整合素蛋白(例如CD11/CD18)和 (c) 免疫球蛋白超家族 [例如细胞间粘附分子-1 (intercellular adhesion
molecule-1, ICAM-1)、血管细胞粘附分子-1和血小板内皮细胞粘附分子-1]。白细胞与内皮细胞的相互作用会导致一系列后果,包括内皮功能障碍、微血管塌陷和血液流动缺陷 (Lefer et al., 1996)。针对这一系列过程中不同成分的药理学干预被认为是应对缺血再灌注损伤的理想策略。
表 6复方中药、单味中药和主要活性成分对缺血再灌注诱导的NF-κB通路的影响
据报道,许多复方中药、单味中药和主要生物活性成分能够抑制白细胞和内皮细胞上的粘附分子表达。我们的实验研究证实了复方丹参滴丸对心脏缺血再灌注后白细胞CD18表达和内皮细胞ICAM-1表达具有抑制作用 (Zhao et al., 2010a);丹参素和总丹酚酸对缺血再灌注后大鼠白细胞上的粘附分子CD11b和CD18的表达以及内皮上的ICAM-1和E-选择素的表达具有抑制作用 (Han et al., 2009; Wang et al., 2010)。咖啡酸 (Mu et al., 2015) 和三七皂苷R1 (Chen et al., 2008) 对缺血再灌注损伤的肝细胞也具有类似的作用。丹参乙酸镁(丹参水提物的主要成分之一)能够降低CD11b的mRNA水平,防止肝缺血再灌注引起的中性粒细胞浸润 (Song et al., 2014b)。黄芪多糖(黄芪的主要成分之一)能够抑制缺血再灌注诱发的人心脏微血管内皮细胞和多形核白细胞之间的粘附,其机制与p38 MAPK的表达和磷酸化的下调有关 (Hai-Yan et al., 2013)。还
有研究发现,人参皂苷Rb1 (Wang et al., 2008a) 和人参皂苷Rg1 (Tao et al., 2014) 等生物活性成分能够抑制缺血再灌注后ICAM-1的过度表达和中性粒细胞的募集。血必净注射液 (Ji et al., 2016) 和人参皂苷Rb1 (Wang et al., 2013b) 可以通过降低ICAM-1的表达水平,保护家兔左心室缺血再灌注或大鼠肠缺血再灌注诱发的急性肺损伤。
表7复方中药、单味中药和主要活性成分对缺血再灌注诱导的线粒体依赖的细胞凋亡的影响
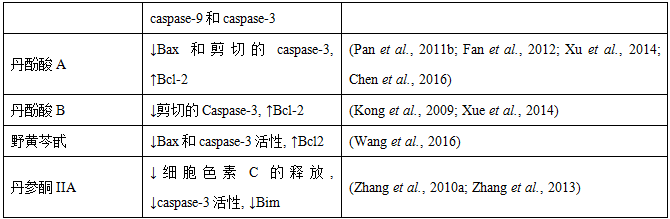
血管内皮在循环血液成分和周围组织之间形成了一个交互界面。缺血再灌注后,血管通透性增加,导致血浆白蛋白漏出,并促使中性粒细胞和其他炎性细胞迁移到受损组织中,进一步加重缺血再灌注损伤(Kumar et al., 2009)。
我们的在体研究发现,复方丹参滴丸预给药和后给药均可以阻止缺血再灌注引起的FITC标记的血浆白蛋白从冠状细静脉漏出,表明复方丹参滴丸能够减轻缺血再灌注引起的血管通透性过高 (Zhao et al., 2010a; Wei et al., 2013b; Yang et al., 2013)。丹参素 (Han et al., 2009)、丹参总酚酸 (Wang et al., 2010) 和三七皂苷R1 (Li et al., 2014b) 预给药和后给药也获得了相同的结果。采用免疫印迹法进一步研究表明,三七皂苷R1治疗可以明显减少再灌注60分钟和3天后,紧密连接蛋白claudin-5、occludin和ZO-1的降解 (Li et al., 2014b)。近期的一项大鼠在体研究发现,养血清脑颗粒预给药和后给药,无论在是在灌注后的早期还是晚期都可以显著抑制缺血再灌注引起的FITC标记的血浆白蛋白从大脑细静脉漏出 (Huang et al., 2012; Wang et al., 2012a)。采用共聚焦显微镜进一步研究表明,在再灌注3小时和6天后,紧密连接蛋白(claudin-5、occludin、JAM-1和ZO-1)的连续分布被破坏,呈点线状分布,并伴有免疫染色的减少。免疫印迹分析显示缺血再灌注引起了紧密连接蛋白的降解。有趣的是,这些结构变化和蛋白降解经过养血清脑颗粒治疗均有明显的恢复。此外,通过电子显微镜和免疫印迹分析发现,养血清脑颗粒可以下调毛细血管内皮细胞的胞浆中的caveolae以及脑组织中caveolin-1的表达。上述结果提示旁细胞通路和跨细胞通路均参与了养血清脑颗粒对脑缺血再灌注损伤的血脑屏障的调节 (Huang et al., 2012)。与之类似,黄连素防止了肠缺血再灌注引起的紧密连接蛋白的改变,包括occludin和ZO-1的异常分布,减轻了紧密连接损伤,保护了肠道的紧密连接屏障功能 (Gu et al., 2013)。研究发现,丹酚酸A可以有效防止内皮细胞损伤。用丹酚酸A对人脐静脉内皮细胞进行预处理,能够显著减轻缺血再灌注诱发的内皮通透性过高、ZO-1的不连续分布及含量的减少、内皮肌动蛋白应激纤维和细胞旁缝隙的形成以及细胞内ROS的生成 (Yang et al., 2014)。研究人员借助数学模型和主成分分析发现,通心络对心肌缺血再灌注损伤的保护作用与心肌的微血管屏障功能有关。通心络能够以合成依赖的方式,在缺血再灌注损伤后数小时,上调血管内皮钙粘蛋白、β-连环蛋白和γ-连环蛋白,或者在缺血再灌注损伤后不久,防止血管内皮钙粘蛋白、β-连环蛋白和γ-连环蛋白的内化 (Qi et al., 2015)。此外,当肌球蛋白轻链激酶磷酸化肌球蛋白轻链,增加原肌球蛋白收缩活性时,也会导致内皮的高通透性。我们的研究发现,芪参益气滴丸和黄芪甲苷能够抑制心肌缺血再灌注引起的调节性肌球蛋白轻链的磷酸化,缓解间质性水肿 (Lin et al., 2013; Tu et al., 2013)。
肥大细胞脱颗粒是缺血再灌注之后的特殊现象之一,可以导致一系列级联反应,例如促炎介质的释放、粘附分子表达的增加、白细胞粘附瑀血管壁增多,以及随后的细静脉或毛细血管通透性的增加。我们的研究证实,丹参素和丹参总酚酸预给药可以减轻缺血再灌注诱导的大鼠肠系膜中肥大细胞脱颗粒,降低微血管的高通透性 (Han et al., 2008; Wang et al., 2010)。
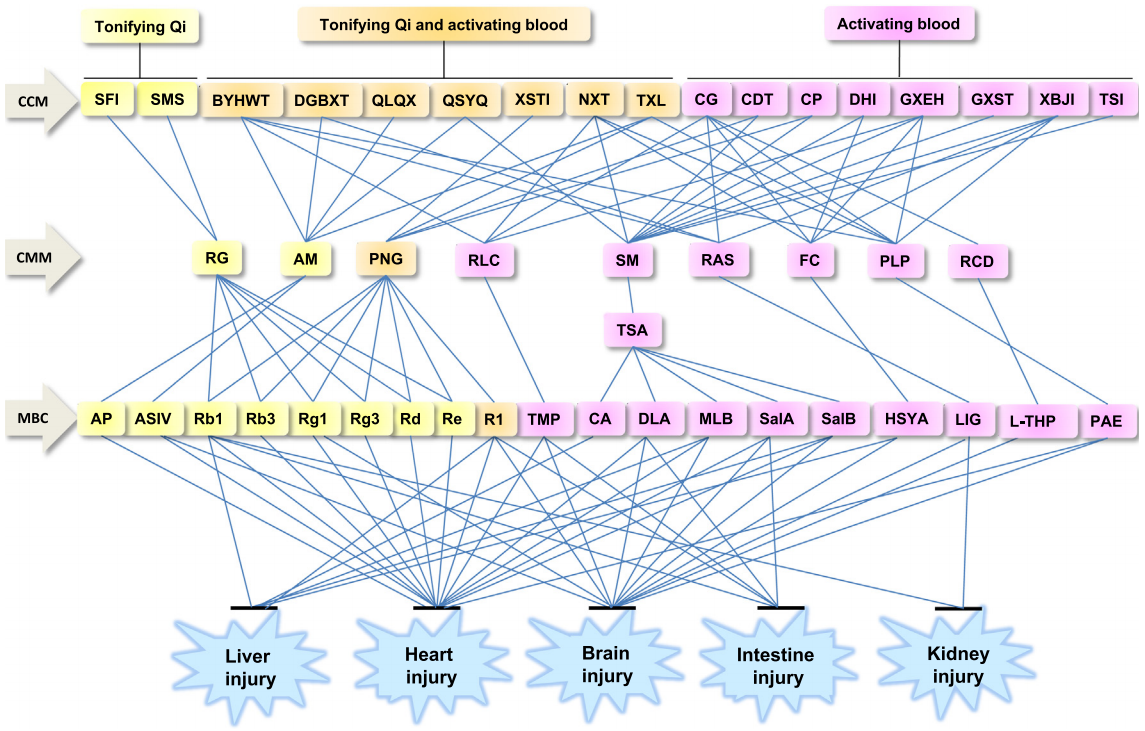
图2. 复方中药、单味中药及其主要活性成分可以减轻缺血再灌注引起的不同器官的微循环障碍和组织损伤。复方中药的功效要归功于其含有的可以补气和/或活血的单味中药。人参、黄芪和三七是具有补气功效的单味中药的代表。黄芪中的黄芪多糖和黄芪甲苷能够改善心脏和脑损伤,而人参和三七中的人参皂苷Rb1 、人参皂苷Rb3、人参皂苷Rg1、人参皂苷Rg3、人参皂苷Rd和人参皂苷Re均可以减轻心肌损伤,其中人参皂苷Rb1对于肠损伤、人参皂苷Rg1对于肝损伤也有功效。三七中的三七皂苷R1 可以改善缺血再灌注损伤后的心脏、脑、肝和肠功能。用于活血的单味中药包括川芎、丹参、当归、红花、芍药和延胡索。丹参的水溶性成分中,咖啡酸对肝脏的缺血再灌注损伤有效;丹参素作用于心脏、脑和肠;丹参乙酸镁和丹酚酸B作用于心脏、脑和肝脏;丹酚酸A作用于心脏和脑。与之类似,川芎中的川芎嗪对于缺血再灌注后的心脏、脑和肝具有功效;芍药中的丹皮酚作用于心脏和脑;红花中的羟基红花黄色素A作用于心脏和肝脏。
AM, 黄芪;AP, 黄芪多糖;ASIV, 黄芪甲苷;BYHWT, 补阳还五汤;CA, 咖啡酸;CCM, 复方中药;CDT, 复方丹参片;CG, 养血清脑颗粒;CMM, 单味中药;CP, 复方丹参滴丸;DHI, 丹红注射液;DGBXT, 当归补血汤;DLA, 丹参素;FC, 红花;GXEH, 冠心二号;GXST, 冠心舒通;HSYA, 羟基红花黄色素A ;L-THP, 延胡索乙素;LIG, 藳本内酯;MBC, 主要活性成分;MLB, 丹参乙酸镁;NXT, 脑心通;PAE, 丹皮酚;PLP, 芍药;PNG, 三七;QLQX, 芪苈强心胶囊;QSYQ, 芪参益气;R1, 三七皂苷R1;RAS, 当归;Rb1, 人参皂甙Rb1;Rb3, 人参皂甙Rb3;RCD, 延胡索;Re, 人参皂甙Re;RG, 人参;Rg1, 人参皂甙Rg1;Rg3, 人参皂甙Rg3;RLC, 川芎;SalA, 丹酚酸A ;SalB, 丹酚酸B;SFI, 参附注射液;SM, 丹参;SMS, 生脉散;TMP, 川芎嗪;TSA, 丹参总酚酸;TSI, 注射用丹参多酚酸;TXL, 通心络;XBJI, 血必净注射液;XSTI, 血塞通注射液;⊥, 减轻
内质网是真核细胞中的一种多功能细胞器官,参与蛋白质的生物合成和折叠。近来,内质网应激在缺血再灌注损伤中的作用已经引起了研究者们的高度重视。缺血再灌注损伤期间ATP的耗竭、异常的氧化状态和钙稳态紊乱均可能导致内质网中错误折叠蛋白的累积,引发非折叠蛋白反应 (Yu et al., 2016b)。非折叠蛋白反应通过三种内质网跨膜受体:蛋白激酶样内质网激酶 (pancreatic ER kinase -like or PKR-like ER kinase, PERK)、活化转录因子6 (activating transcription factor 6, ATF6) 和肌醇酶1α (inositol-requiring enzyme-1α, IRE1α) 介导内质网应激。作为非折叠蛋白反应的靶基因,葡萄糖调节蛋白78 (glucose-regulated protein 78, GRP78) 在内质网应激时激活内质网应激感应分子,以适应不断变化的环境。然而,长期或过度的内质网应激最终将导致细胞凋亡、炎症、自噬和许多其他病理生理过程,引发缺血再灌注损伤 (Kim et al., 2008)。
研究证实,黄连素能够降低PERK和真核细胞起始因子2α (eukaryotic initiation factor 2α, eIF2α) 的磷酸化水平,以及ATF4和C/EBP同源蛋白的表达,减少心肌缺血再灌注损伤引起的内质网应激。重要的是,已经证实JAK2 / STAT3信号传导在该过程中发挥了关键作用 (Zhao et al., 2016a)。在另一项研究中,体内和体外实验均表明,三七皂苷R1通过抑制GRP78和内质网应激感应分子PERK、ATF6和IRE1α的过度表达,改善了缺血再灌注诱发的心肌细胞死亡,延迟了内质网应激的发生。尤其是在分离的心脏组织和H9c2细胞中,三七皂苷R1显著抑制了PERK和eIF2α的磷酸化水平,表明三七皂苷R1通过GRP78-PERK/eIF2α相关通路对内质网应激产生了直接的抑制作用。离体和体外实验也发现,三七皂苷R1还能够防止特异的内质网应激诱导剂衣霉素诱发的心肌损伤,这进一步证实了内质网应激和三种未折叠蛋白反应通路与三七皂苷R1的保护作用有关 (Yu et al., 2016b)。
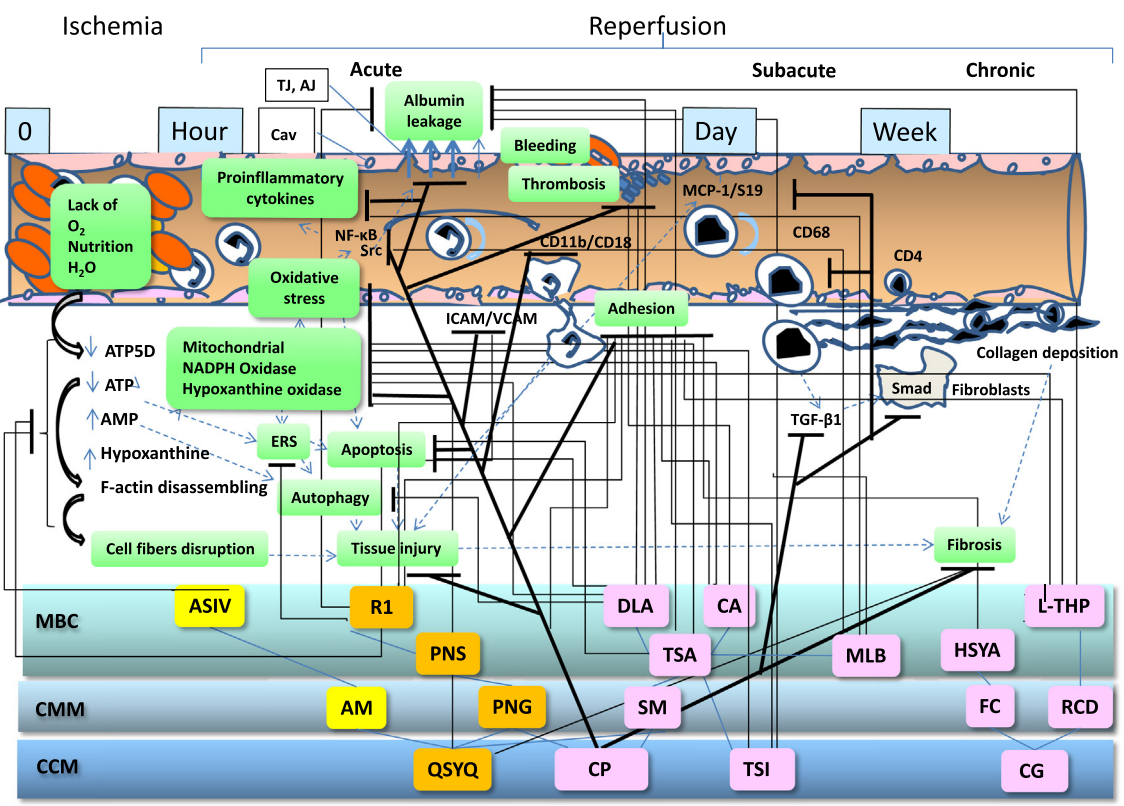
图3 一些复方中药、单味中药及其主要活性成分在缺血再灌注引起的微循环障碍和器官损伤不同阶段中的作用机制。
AJ,粘附连接;AM,黄芪;ASIV,黄芪甲苷;ATP,三磷酸腺苷;CA,咖啡酸;Cav,胞膜窖;CCM,复方中药;CG,养血清脑颗粒;CMM,单味中药;CP,复方丹参滴丸;DLA,丹参素;ERS,内质网应激;FC,红花;HYSA,羟基红花黄色素A;ICAM,细胞间粘附分子-1;L-THP,延胡索乙素;MBC,主要生物活性成分;MCP-1,单核细胞趋化蛋白1 ;MLB,丹参乙酸镁;PNG,三七;PNS, 三七总皂苷;QSYQ,芪参益气;R1,三七皂苷R1;RCD,延胡索;S19,核糖体蛋白S19 ;SM,丹参;TGF-β1,转化生长因子β1;TJ,紧密连接;TSA,丹参总酚酸;TSI,注射用丹参多酚酸;VCAM,血管细胞粘附分子;虚线箭头,诱发;↑,增加;↓,减少;⊥,抑制
众所周知,缺血再灌注会引起细胞凋亡,它主要发生在再灌注阶段 (Eefting et al., 2004),涉及一个有序的caspase信号级联,最终导致在末期以细胞及其细胞核的皱缩而胞膜完整为特征的特异性程序化细胞死亡 (Eltzschig et al., 2011)。介导细胞凋亡的通路有两种:线粒体依赖的通路和非线粒体依赖的通路。不同的细胞毒性刺激(包括氧化应激),通过激活B细胞淋巴瘤-2(B-cell lymphoma-2, Bcl-2)同源性3家族蛋白,抑制促进存活的Bcl-2样蛋白,活化促凋亡效应分子Bax和Bak,继而破坏线粒体外膜。引发线粒体依赖的细胞凋亡。从线粒体释放的细胞色素C促进了凋亡蛋白酶活化因子1上的caspase 9的活化,而释放的第2个线粒体衍生的caspase激活剂能够阻断caspase抑制剂 — X连锁凋亡抑制蛋白,从而促进细胞凋亡 (Czabotar et al., 2014)。
许多复方中药能够通过干预线粒体依赖型细胞凋亡防止缺血再灌注损伤,caspase-3、caspase-9、Bcl-2 / Bax、PI-3K、Akt以及细胞色素C的水平或活性是最常用于效应检测的生物标志物。我们和其他研究团队的研究均表明,复方丹参滴丸可以使Bax和Bcl-2之间的平衡倾向于抗细胞凋亡状态,减少心肌TUNEL阳性细胞数量,减少caspase-3表达,减轻缺血后大鼠心肌细胞凋亡 (Zhao et al., 2010a; Yang et al., 2013; Jun et al., 2014)。其他复方中药、单味中药和主要生物活性成分也被证明能够抑制缺血再灌注诱发的线粒体依赖型凋亡,表现为Bax蛋白降低,Bcl-2蛋白增加,caspase-3表达和活性降低。大量的复方中药、单味中药和生物活性成分已被证明在缺血再灌注中能够发挥类似的抗细胞凋亡作用(表7)。
非线粒体依赖的细胞凋亡通路也称为死亡受体介导的(或外源性)凋亡通路。当TNF家族的某些死亡受体配体(如FAS配体和TNF)与细胞膜上同源的死亡受体FAS和TNFR1结合后,通过FAS相关的死亡结构域蛋白和TNFR相关的死亡结构域蛋白导致caspase 8的激活 (Czabotar et al., 2014)。研究显示,一些复方中药、单味中药和主要生物活性成分的抗细胞凋亡活性依赖于外源性细胞凋亡通路关键的死亡受体Fas/FasL的下调。例如,芪苈强心胶囊 (Xiao et al., 2015) 能够通过降低Fas和caspase-3的表达来抑制缺血再灌注诱发的心肌细胞凋亡。氧化苦参碱通过下调Fas和FasL依赖的抗细胞凋亡活性减轻了大鼠肠缺血再灌注损伤 (Zhao et al., 2008)。此外,黄芩苷预给药能够显著降低肝缺血再灌注后TNFR相关死亡结构域蛋白的表达水平,以及caspase-3和caspase-8的活化,表明黄芩苷对肝的保护作用可能与TNF介导的凋亡通路相关 (Kim et al., 2010)
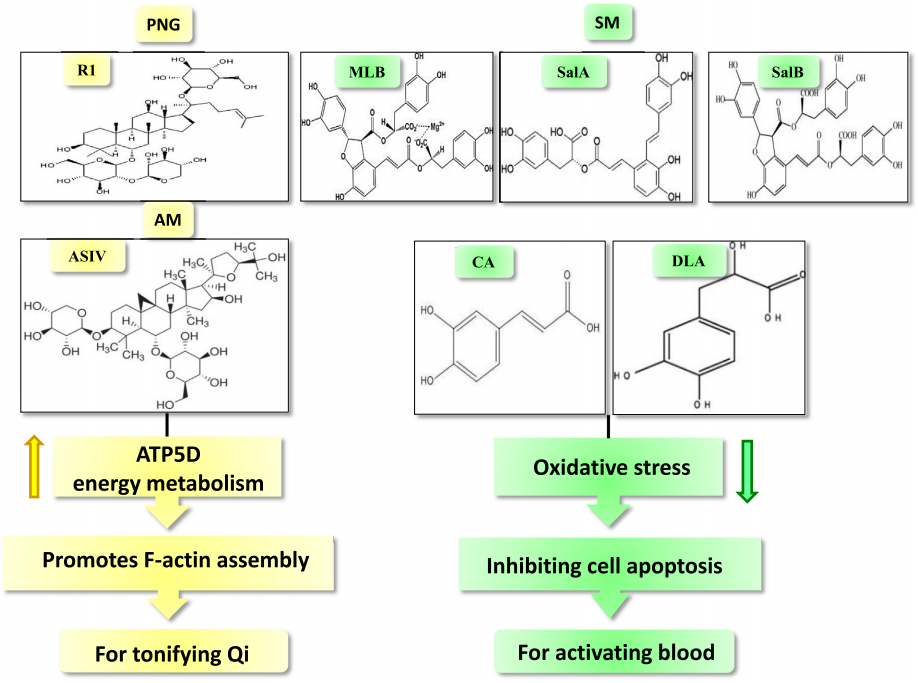
图4 从补气的单味中药中提取的皂苷类化合物,例如黄芪甲苷和三七皂苷R1,能够上调ATP5D的表达,从而改善能量代谢和保护细胞骨架。活血的单味中药 (如丹参) 中的酚酸类化合物含有多个酚羟基,能够抑制NADPH氧化酶亚基的膜转位,从而使NADPH氧化酶失活,抑制超氧化物的生成。此外,这类化合物也能够上调线粒体呼吸链复合物I的表达和活性,导致过氧化物的产生受到抑制,防止细胞凋亡。AM,黄芪;ASIV,黄芪甲苷;CA,咖啡酸;DLA,丹参素;MLB,丹参乙酸镁;PNG,三七;R1,三七皂苷R1;SalA,丹酚酸A;SalB,丹酚酸 B;SM,丹参。
自噬是一种严格调控的细胞内分解代谢过程,也是一种细胞质量控制机制,用于处理受损和功能失调的细胞器和蛋白质聚集体。自噬受损会导致功能障碍的细胞器和蛋白质的累积,造成内质网应激和细胞凋亡 (Ginsberg, 2016)。自噬通路由四个独特且连续的步骤组成:(i) 起始;(ii) 形成自噬体;(iii) 通过与溶酶体的对接和融合产生自噬溶酶体;(iv) 所含物质的最终降解和再循环 (Przyklenk et al., 2012)。在已报道的参与协调的自噬过程的多种蛋白质复合物和信号通路中,有一些关键的介导因子,包括AMPK、哺乳动物雷帕霉素靶蛋白 (mammalian target of rapamycin, mTOR)、PI3K、Beclin-1、微管相关蛋白1轻链3 (microtubule-associated protein 1 light chain 3, LC3) 和自噬相关基因产物 (Ma et al., 2015)。缺血再灌注损伤导致过度自噬,具有细胞毒性,会损害大部分的细胞质和细胞器,最终导致细胞功能的完全崩溃直至细胞死亡 (Przyklenk et al., 2012)。预防过度自噬可以作为一种新型的针对缺血再灌注损伤的心脏保护策略。
缺血再灌注诱发心肌损伤后,使用黄连素能够显著减少梗死面积,改善心脏功能,其潜在的作用机制就是抑制过度自噬。研究表明,黄连素通过降低自噬相关蛋白(如LC3-II、Sirt1、Bcl-2/腺病毒E1B 19kDa相互作用蛋白3和Beclin-1)显著抑制自噬,保护H9c2细胞免于缺氧/再给氧诱导的细胞死亡。进一步研究发现,黄连素治疗抑制了AMPK和mTORC2的活化,与缺氧/再给氧的H9c2细胞自噬减少密切相关。在缺血再灌注小鼠模型中,再灌注前黄连素单次给药(5或10 mg/kg)显著减少了小鼠心肌细胞的自噬 (Huang et al., 2015b)。丹参素也可以通过减少自噬体的形成,抑制自噬标志物p62、LC3-II和Beclin-1的蛋白表达;以及上调mTOR信号传导,从而减轻缺血再灌注期间的心肌自噬 (Fan et al., 2016)。
自噬也可以作为肝缺血再灌注损伤期间的一种保护机制,诱导自噬已经成为缺血再灌注损伤后改善肝功能的一种新型潜在策略 (Cursio et al., 2015)。研究发现,黄芩素能够通过诱导血红素加氧酶-1介导的自噬来减轻肝脏缺血再灌注损伤。黄芩素治疗显着提高了肝脏中LC3B-II的表达水平,增大了缺血再灌注损伤后的自噬潮。此外,黄芩素治疗显著增加了大鼠缺血再灌注损伤后自噬体的数量 (Liu et al., 2016a)。
纤维化是器官缺血再灌注损伤的后续结果,其中成纤维细胞发挥了至关重要的作用。缺血损伤后,成纤维细胞转变为一种特殊类型的细胞,称为肌成纤维细胞,其标志是过量分泌形成的大量α平滑肌肌动蛋白 (α-smooth muscle actin, α-SMA)。肌成纤维细胞在组织和器官重构过程中发挥关键作用,能够形成富含胶原蛋白的瘢痕,使得梗死区在细胞死亡后仍然保持结构的完整性。然而,当肌成纤维细胞活性过高并且持续时间较长时,有益的组织修复就会转变为有害的以器官纤维化为典型特征的组织畸形 (Hinz et al., 2012)。
多种复方中药已证实在减少肌成纤维细胞增殖和活化方面效果显著,从而缓解了缺血再灌注后组织的纤维化重构。我们的研究证实,复方丹参滴丸后给药能够通过减少单核细胞趋化因子RP S19二聚体的释放、单核细胞迁移、TGF-β1/Smads信号分子表达、MMP-9表达、成纤维细胞活化以及随后的胶原沉积,抑制缺血再灌注诱发心梗后的心肌纤维化。上述结果不仅为理解复方丹参滴丸减轻缺血再灌注引发心梗后的心肌纤维化的作用机制提供了研究框架,而且提示了RP S19二聚体作为一个潜在靶点,可用于研发针对缺血再灌注后有心肌纤维化风险患者的新型预防措施 (Wei et al., 2013b)。研究发现,芪参益气可以通过作用于肾素-血管紧张素-醛固酮系统的不同靶点,尤其是肾素、血管紧张素II、血管紧张素转换酶2和血管紧张素II 1型受体 (Ang II type 1 receptor, AT1) /AT2,最终降低MMP-9和TGF-β的水平,从而改善心肌重构 (Wang et al., 2012b)。在另一项研究中,芪参益气被证实能够以协同的方式通过不同的通路,包括血管紧张素II-NADPH氧化酶-ROS-MMP通路、TNFα-NF-κB和白介素-6-STAT3通路,保护左前降支冠状动脉结扎诱发的左心室重构,恢复血液动力学参数,使心脏功能正常化,对心力衰竭提供了综合的心脏保护功效 (Li et al., 2014a)。芪参益气还可以通过抑制肾素-血管紧张素-醛固酮系统激活的通路来减轻心梗诱发的心衰大鼠的心肌纤维化,表现为AT1表达减少和AT2表达增加,以及随后的花生四烯酸代谢通路活化的抑制。此外,芪参益气降低了包括JAK1/STAT3、NF-κB和Akt在内的信号转导蛋白的表达,表明芪参益气的心脏保护作用可能是通过RAAS-JAK1/STAT3、NF-κB和Akt通路进行介导的 (Wang et al., 2015a)。还有研究发现,瓜蒌薤白汤能够改善心脏损伤,防止大鼠心肌纤维化,其作用可能与下调Smad2/3的表达,上调Smad7的表达,抑制TGF-β1信号通路,或下调NF-κB和NF-κB的靶细胞因子(如TNF-α和MCP-1)的表达相关 (Ding et al., 2013; Ding et al., 2016)。在治疗慢性心力衰竭患者的临床试验中,芪苈强心胶囊已被证明是安全、有效的 (Li et al., 2013)。已有研究表明,它对心脏功能有明显的改善作用,可以缓解缺血再灌注后mTOR通路激活介导的心脏的重构进程 (Zhou et al., 2015)。此外,芪苈强心胶囊给药4周能够改善心梗后充血性心力衰竭大鼠的肺组织结构重塑。芪苈强心胶囊抗纤维化作用的实现主要是通过抑制TGF-β1/ Smad3信号通路,减少肌成纤维细胞的增殖和胶原沉积。其作用机制可能与抑制TLR4的细胞内信号传导有关 (He et al., 2015)。
缺血再灌注后线粒体电子传递障碍
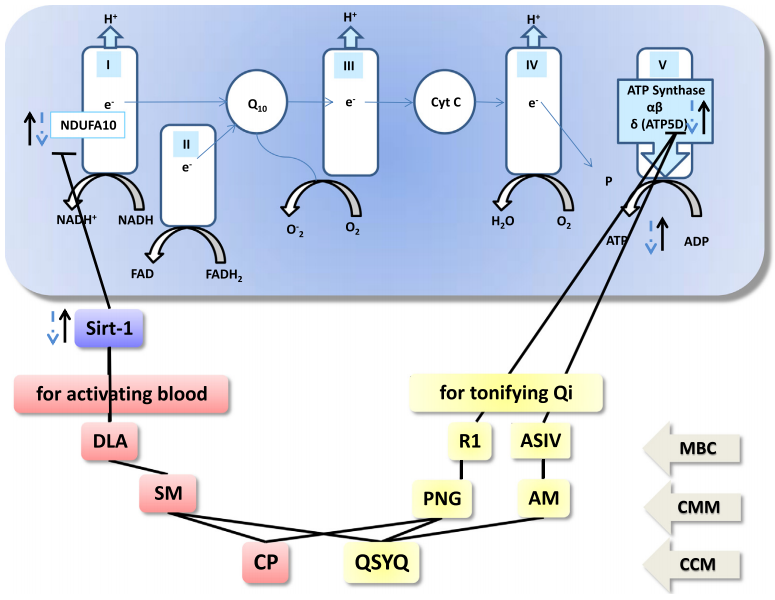
图5 两个例子表明复方中药在治疗缺血再灌注引起的微循环障碍和器官损伤方面的优越性,归因于其具有作用于多靶点的潜能。
I,线粒体复合体I;II,线粒体复合物II;III,线粒体复合物III;IV,线粒体复合体IV;V,线粒体复合物V;ADP,二磷酸腺苷;AM,黄芪;ASIV,黄芪甲苷IV;ATP,三磷酸腺苷;CCM, 复方中药;CMM,单味中药;CP,复方丹参滴丸;Cyt C,细胞色素C;DLA,丹参素;FAD,黄素腺嘌呤二核苷酸;MBC,主要生物活性成分;NADH,烟酰胺腺嘌呤二核苷酸;NDUFA,NADH脱氢酶(泛醌)1α亚复合体;PNG,三七;Q10,辅酶Q10;QSYQ,芪参益气;R1,三七皂苷R1;Sirt,去乙酰化酶;SM,丹参;⊥,抑制;↑,治疗后增加;虚线箭头,缺血再灌注后减少。
复方中药能够改善缺血再灌注引起的微循环障碍和器官损伤,源于这两类单味中药中所含的主要生物活性成分的协同作用,而且这些主要生物活性成分可作用于多个器官,并没有器官特异性(图2)。
已有的数据表明芪参益气和复方丹参滴丸含有能够调节能量代谢的成分(黄芪甲苷和三七皂苷R1)。芪参益气、复方丹参滴丸、注射用丹参多酚酸和养血清脑颗粒含有的成分能够抑制氧化应激(咖啡酸、丹参素、羟基红花黄色素A和延胡索乙素)、白细胞粘附于内皮细胞(咖啡酸、丹参素和延胡索乙素)、血浆白蛋白漏出(丹参素、延胡索乙素和三七皂苷R1)、炎症(咖啡酸、丹参素、羟基红花黄色素A、丹参乙酸镁和三七皂苷R1)以及凋亡(咖啡酸、丹参素、羟基红花黄色素A和三七皂苷R1)。此外,缺血再灌注期间,三七皂苷R1和丹参素能够分别减少内质网应激和自噬。缺血再灌注后微循环障碍和器官损伤的改善正是上述成分协调共同作用的结果(图3)。
黄芪中的黄芪甲苷以及三七中的三七皂苷Rb1、Rg1和R1均为皂苷类化合物,其中的黄芪甲苷和三七皂苷R1能够上调ATP5D在线粒体呼吸链中的表达,从而改善能量代谢。丹参中的丹酚酸A、丹酚酸B、咖啡酸和丹参素能够抑制过氧化物的生成和凋亡,其结构中均含有酚羟基基团(图4)。上述信息将有助于发现更多具有类似潜力的生物活性成分,研制开发作用于相似靶点的新药。
以复方丹参滴丸为例,丹参素与Sirt1结合后上调复合物I的亚基NDUFA10,恢复线粒体中的电子传递,从而减少了电子逸出和超氧阴离子的生成。复方丹参滴丸也含有三七总皂苷,包括三七皂苷R1,已证实其能够上调ATPase 的亚基ATP5D,恢复ATP的生成 (He et al., 2014)。复方丹参滴丸中的三七皂苷R1和丹参素协同作用,促进了ATP的生成,同时抑制了超氧阴离子的释放,这就是缺血再灌注引起的微循环障碍和器官损伤发生时复方丹参滴丸能够发挥预期作用的原因。芪参益气滴丸也具有相似的情形(图5)。
例如,养血清脑颗粒预给药能够防止缺血再灌注引起的脑微循环障碍,减轻海马和皮层的神经元损伤。在再灌注后3小时,开始出现脑微循环障碍和神经细胞损伤时,连续给予养血清脑颗粒显示,脑血管内皮细胞产生的过氧化物、粘附于内皮的白细胞和白蛋白漏出的明显减少。养血清脑颗粒对血脑屏障高通透性的保护作用则归因于抑制内皮细胞中caveolae的增加和内皮细胞间连接蛋白的改善。复方丹参滴丸及其主要生物活性成分丹参素和丹参总酚酸也具有类似的作用 (Han et al., 2009; Wang et al., 2010)。
总的来说,越来越多的复方中药显示出了缓解缺血再灌注引起的微循环障碍和器官损伤的潜力。即使在缺血再灌注引起的心脏微循环障碍和组织损伤发生之后服用,有些复方中药还能够改善微循环障碍和心脏纤维化。这要归因于在这些复方中所含有的能够改善能量代谢、抑制氧化应激、炎症、粘附分子表达、细胞骨架破坏和凋亡的多种活性成分。上述结果突出了复方中药是预防和治疗缺血再灌注损伤的非常有前景的候选方案。
作者声明不存在任何利益冲突。
参考文献
Ahn BH, Kim HS, Song S, Lee IH, Liu J, Vassilopoulos A, et al. (2008). A role for the mitochondrial deacetylase Sirt3 in regulating energy homeostasis. Proc Natl Acad Sci U S A 105: 14447-14452.
Babior BM (1999). NADPH oxidase: an update. Blood 93: 1464-1476.
Bagheri F, Khori V, Alizadeh AM, Khalighfard S, Khodayari S, Khodayari H (2016). Reactive oxygen species-mediated cardiac-reperfusion injury: Mechanisms and therapies. Life Sci 165: 43-55.
Bedard K, Krause KH (2007). The NOX family of ROS-generating NADPH oxidases: physiology and pathophysiology. Physiol Rev 87: 245-313.
Binder A, Ali A, Chawla R, Aziz HA, Abbate A, Jovin IS (2015). Myocardial protection from ischemia-reperfusion injury post coronary revascularization. Expert Rev Cardiovasc Ther 13: 1045-1057.
Cai G, Liu B, Liu W, Tan X, Rong J, Chen X, et al. (2007). Buyang Huanwu Decoction can improve recovery of neurological function, reduce infarction volume, stimulate neural proliferation and modulate VEGF and Flk1 expressions in transient focal cerebral ischaemic rat brains. J Ethnopharmacol 113: 292-299.
Cai M, Yu Z, Wang L, Song X, Zhang J, Zhang Z, et al. (2016). Tongxinluo reduces brain edema and inhibits post-ischemic inflammation after middle cerebral artery occlusion in rats. J Ethnopharmacol 181: 136-145.
Cai Q, Li X, Wang H (2001). Astragali and Angelica protect the kidney against ischemia and reperfusion injury and accelerate recovery. Chin Med J (Engl) 114: 119-123.
Cao ZQ, Quan W, Hou SX, Guo C, Ma SB, Zhang W, et al. (2015). The natural therapeutic magnesium lithospermate B potently provides neuroprotective effects on cerebral ischemia/reperfusion injury in rats. Journal of ethnopharmacology 162: 191-198.
Chang W, Li K, Guan F, Yao F, Yu Y, Zhang M, et al. (2016). Berberine Pretreatment Confers Cardioprotection Against Ischemia-Reperfusion Injury in a Rat Model of Type 2 Diabetes. Journal of cardiovascular pharmacology and therapeutics.
Chang W, Zhang M, Li J, Meng Z, Xiao D, Wei S, et al. (2012). Berberine attenuates ischemia-reperfusion injury via regulation of adenosine-5'-monophosphate kinase activity in both non-ischemic and ischemic areas of the rat heart. Cardiovascular drugs and therapy / sponsored by the International Society of Cardiovascular Pharmacotherapy 26: 467-478.
Chang WT, Li J, Vanden Hoek MS, Zhu X, Li CQ, Huang HH, et al. (2013). Baicalein preconditioning protects cardiomyocytes from ischemia-reperfusion injury via mitochondrial oxidant signaling. The American journal of Chinese medicine 41: 315-331.
Chen JR, Wei J, Wang LY, Zhu Y, Li L, Olunga MA, et al. (2015a). Cardioprotection against ischemia/reperfusion injury by QiShenYiQi Pill(R) via ameliorate of multiple mitochondrial dysfunctions. Drug Des Devel Ther 9: 3051-3066.
Chen K, Li G, Geng F, Zhang Z, Li J, Yang M, et al. (2014). Berberine reduces ischemia/reperfusion-induced myocardial apoptosis via activating AMPK and PI3K-Akt signaling in diabetic rats. Apoptosis 19: 946-957.
Chen Q, Xu T, Li D, Pan D, Wu P, Luo Y, et al. (2016). JNK/PI3K/Akt signaling pathway is involved in myocardial ischemia/reperfusion injury in diabetic rats: effects of salvianolic acid A intervention. Am J Transl Res 8: 2534-2548.
Chen R, Shao H, Lin S, Zhang JJ, Xu KQ (2011). Treatment with Astragalus membranaceus produces antioxidative effects and attenuates intestinal mucosa injury induced by intestinal ischemia-reperfusion in rats. Am J Chin Med 39: 879-887.
Chen SY, Hsiao G, Hwang HR, Cheng PY, Lee YM (2006). Tetramethylpyrazine induces heme oxygenase-1 expression and attenuates myocardial ischemia/reperfusion injury in rats. J Biomed Sci 13: 731-740.
Chen WX, Wang F, Liu YY, Zeng QJ, Sun K, Xue X, et al. (2008). Effect of notoginsenoside R1 on hepatic microcirculation disturbance induced by gut ischemia and reperfusion. World J Gastroenterol 14: 29-37.
Chen Y, Wu X, Yu S, Fauzee NJ, Wu J, Li L, et al. (2012a). Neuroprotective capabilities of Tanshinone IIA against cerebral ischemia/reperfusion injury via anti-apoptotic pathway in rats. Biol Pharm Bull 35: 164-170.
Chen Y, Wu X, Yu S, Lin X, Wu J, Li L, et al. (2012b). Neuroprotection of tanshinone IIA against cerebral ischemia/reperfusion injury through inhibition of macrophage migration inhibitory factor in rats. PLoS One 7: e40165.
Chen YY, Li Q, Pan CS, Yan L, Fan JY, He K, et al. (2015b). QiShenYiQi Pills, a compound in Chinese medicine, protects against pressure overload-induced cardiac hypertrophy through a multi-component and multi-target mode. Sci Rep 5: 11802.
Cheng X, Luo H, Zhou L, Wang L, Sun J, Huang Y, et al. (2014). Neuroprotective effect of the traditional Chinese herbal formula Tongxinluo: a PET imaging study in rats. Neural Regen Res 9: 1267-1274.
Cheng YT, Yang YJ, Zhang HT, Qian HY, Zhao JL, Meng XM, et al. (2009). Pretreatment with Tongxinluo protects porcine myocardium from ischaemia/reperfusion injury through a nitric oxide related mechanism. Chin Med J (Engl) 122: 1529-1538.
Chiu PY, Leung HY, Siu AH, Poon MK, Ko KM (2007). Schisandrin B decreases the sensitivity of mitochondria to calcium ion-induced permeability transition and protects against ischemia-reperfusion injury in rat hearts. Acta Pharmacol Sin 28: 1559-1565.
Cho EJ, Yokozawa T, Rhee SH, Park KY (2004). The role of Coptidis Rhizoma extract in a renal ischemia-reperfusion model. Phytomedicine 11: 576-584.
Cursio R, Colosetti P, Gugenheim J (2015). Autophagy and liver ischemia-reperfusion injury. Biomed Res Int 2015: 417590.
Czabotar PE, Lessene G, Strasser A, Adams JM (2014). Control of apoptosis by the BCL-2 protein family: implications for physiology and therapy. Nat Rev Mol Cell Biol 15: 49-63.
de Perrot M, Liu M, Waddell TK, Keshavjee S (2003). Ischemia-reperfusion-induced lung injury. Am J Respir Crit Care Med 167: 490-511.
Deng Y, Yang M, Xu F, Zhang Q, Zhao Q, Yu H, et al. (2015). Combined Salvianolic Acid B and Ginsenoside Rg1 Exerts Cardioprotection against Ischemia/Reperfusion Injury in Rats. PLoS One 10: e0135435.
Ding YF, Peng YR, Shen H, Shu L, Wei YJ (2016). Gualou Xiebai decoction inhibits cardiac dysfunction and inflammation in cardiac fibrosis rats. BMC Complement Altern Med 16: 49.
Ding YF, Peng YR, Li J, Shen H, Shen MQ, Fang TH (2013). Gualou Xiebai Decoction prevents myocardial fibrosis by blocking TGF-beta/Smad signalling. J Pharm Pharmacol 65: 1373-1381.
Eefting F, Rensing B, Wigman J, Pannekoek WJ, Liu WM, Cramer MJ, et al. (2004). Role of apoptosis in reperfusion injury. Cardiovasc Res 61: 414-426.
Eltzschig HK, Eckle T (2011). Ischemia and reperfusion--from mechanism to translation. Nat Med 17: 1391-1401.
Fan G, Yu J, Asare PF, Wang L, Zhang H, Zhang B, et al. (2016). Danshensu alleviates cardiac ischaemia/reperfusion injury by inhibiting autophagy and apoptosis via activation of mTOR signalling. J Cell Mol Med.
Fan H, Yang L, Fu F, Xu H, Meng Q, Zhu H, et al. (2012). Cardioprotective effects of salvianolic Acid a on myocardial ischemia-reperfusion injury in vivo and in vitro. Evid Based Complement Alternat Med 2012: 508938.
Feng L, Xiong Y, Cheng F, Zhang L, Li S, Li Y (2004). Effect of ligustrazine on ischemia-reperfusion injury in murine kidney. Transplant Proc 36: 1949-1951.
Ferrari RS, Andrade CF (2015). Oxidative Stress and Lung Ischemia-Reperfusion Injury. Oxid Med Cell Longev 2015: 590987.
Fu YQ, Hua C, Zhou J, Cheng BR, Zhang J (2013). Protective effects of ginseng total saponins against hepatic ischemia/reperfusion injury in experimental obstructive jaundice rats. Pharm Biol 51: 1545-1551.
Gao XQ, Yang CX, Chen GJ, Wang GY, Chen B, Tan SK, et al. (2010). Ginsenoside Rb1 regulates the expressions of brain-derived neurotrophic factor and caspase-3 and induces neurogenesis in rats with experimental cerebral ischemia. J Ethnopharmacol 132: 393-399.
Ge G, Zhang Q, Ma J, Qiao Z, Huang J, Cheng W, et al. (2014). Protective effect of Salvia miltiorrhiza aqueous extract on myocardium oxidative injury in ischemic-reperfusion rats. Gene 546: 97-103.
Ginsberg MD (2016). Expanding the concept of neuroprotection for acute ischemic stroke: The pivotal roles of reperfusion and the collateral circulation. Prog Neurobiol 145-146: 46-77.
Gonzalez LM, Moeser AJ, Blikslager AT (2015). Animal models of ischemia-reperfusion-induced intestinal injury: progress and promise for translational research. Am J Physiol Gastrointest Liver Physiol 308: G63-75.
Gu DM, Lu PH, Zhang K, Wang X, Sun M, Chen GQ, et al. (2015). EGFR mediates astragaloside IV-induced Nrf2 activation to protect cortical neurons against in vitro ischemia/reperfusion damages. Biochem Biophys Res Commun 457: 391-397.
Gu L, Li N, Yu W, Gong J, Li Q, Zhu W, et al. (2013). Berberine reduces rat intestinal tight junction injury induced by ischemia-reperfusion associated with the suppression of inducible nitric oxide synthesis. Am J Chin Med 41: 1297-1312.
Guan Y, Yin Y, Zhu YR, Guo C, Wei G, Duan JL, et al. (2013). Dissection of mechanisms of a chinese medicinal formula: danhong injection therapy for myocardial ischemia/reperfusion injury in vivo and in vitro. Evid Based Complement Alternat Med 2013: 972370.
Guo C, Yin Y, Duan J, Zhu Y, Yan J, Wei G, et al. (2015). Neuroprotective effect and underlying mechanism of sodium danshensu [3-(3,4-dihydroxyphenyl) lactic acid from Radix and Rhizoma Salviae miltiorrhizae = Danshen] against cerebral ischemia and reperfusion injury in rats. Phytomedicine 22: 283-289.
Guo J, Wang SB, Yuan TY, Wu YJ, Yan Y, Li L, et al. (2013). Coptisine protects rat heart against myocardial ischemia/reperfusion injury by suppressing myocardial apoptosis and inflammation. Atherosclerosis 231: 384-391.
Ha T, Liu L, Kelley J, Kao R, Williams D, Li C (2011). Toll-like receptors: new players in myocardial ischemia/reperfusion injury. Antioxid Redox Signal 15: 1875-1893.
Hai-Yan Z, Yong-Hong G, Zhi-Yao W, Bing X, Ai-Ming W, Yan-Wei X, et al. (2013). Astragalus Polysaccharide Suppresses the Expression of Adhesion Molecules through the Regulation of the p38 MAPK Signaling Pathway in Human Cardiac Microvascular Endothelial Cells after Ischemia-Reperfusion Injury. Evid Based Complement Alternat Med 2013: 280493.
Han JY, Horie Y, Fan JY, Sun K, Guo J, Miura S, et al. (2009). Potential of 3,4-dihydroxy-phenyl lactic acid for ameliorating ischemia-reperfusion-induced microvascular disturbance in rat mesentery. Am J Physiol Gastrointest Liver Physiol 296: G36-44.
Han JY, Horie Y, Li D, Akiba Y, Nagata H, Miura S, et al. (2006). Attenuating effect of Myakuryu on mesenteric microcirculatory disorders induced by ischemia and reperfusion. Clin Hemorheol Microcirc 34: 145-150.
Han JY, Fan JY, Horie Y, Miura S, Cui DH, Ishii H, et al. (2008). Ameliorating effects of compounds derived from Salvia miltiorrhiza root extract on microcirculatory disturbance and target organ injury by ischemia and reperfusion. Pharmacol Ther 117: 280-295.
Han Y, Zhou M, Xing L, Jiang M, Bai G, Luo G (2015). Identification of NF-kappaB inhibitors in Qishenyiqi dropping pills for myocardial infarction treatment based on bioactivity-integrated UPLC-Q/TOF MS. Biomedical chromatography : BMC 29: 1612-1618.
Hao HF, Liu LM, Liu YY, Liu J, Yan L, Pan CS, et al. (2014). Inhibitory effect of rhynchophylline on contraction of cerebral arterioles to endothelin 1: role of rho kinase. J Ethnopharmacol 155: 147-153.
Harhaj NS, Antonetti DA (2004). Regulation of tight junctions and loss of barrier function in pathophysiology. Int J Biochem Cell Biol 36: 1206-1237.
He B, Chen P, Yang J, Yun Y, Zhang X, Yang R, et al. (2012). Neuroprotective effect of 20(R)-ginsenoside Rg(3) against transient focal cerebral ischemia in rats. Neurosci Lett 526: 106-111.
He F, Xu BL, Chen C, Jia HJ, Wu JX, Wang XC, et al. (2016). Methylophiopogonanone A suppresses ischemia/reperfusion-induced myocardial apoptosis in mice via activating PI3K/Akt/eNOS signaling pathway. Acta Pharmacol Sin 37: 763-771.
He FY, Deng KW, Liu WL, Shi JL, Wu Y, Liu W, et al. (2013). [Experimental studies on pharmacokinetics of three components in Buyanghuanwu injection on base of total quantum statistical moment]. Zhongguo Zhong Yao Za Zhi 38: 253-262.
He K, Yan L, Pan CS, Liu YY, Cui YC, Hu BH, et al. (2014). ROCK-dependent ATP5D modulation contributes to the protection of notoginsenoside NR1 against ischemia-reperfusion-induced myocardial injury. Am J Physiol Heart Circ Physiol 307: H1764-1776.
He Y, Du B, Fan H, Cao J, Liu ZW, Zhao Y, et al. (2015). Beneficial Effects of Qili Qiangxin Capsule on Lung Structural Remodeling in Ischemic Heart Failure via TGF-beta1/Smad3 Pathway. Evid Based Complement Alternat Med 2015: 298631.
Hinz B, Phan SH, Thannickal VJ, Prunotto M, Desmouliere A, Varga J, et al. (2012). Recent developments in myofibroblast biology: paradigms for connective tissue remodeling. Am J Pathol 180: 1340-1355.
Horie Y, Han JY, Mori S, Konishi M, Kajihara M, Kaneko T, et al. (2005). Herbal cardiotonic pills prevent gut ischemia/reperfusion-induced hepatic microvascular dysfunction in rats fed ethanol chronically. World J Gastroenterol 11: 511-515.
Hu G, Wu Z, Yang F, Zhao H, Liu X, Deng Y, et al. (2013). Ginsenoside Rd blocks AIF mitochondrio-nuclear translocation and NF-kappaB nuclear accumulation by inhibiting poly(ADP-ribose) polymerase-1 after focal cerebral ischemia in rats. Neurol Sci 34: 2101-2106.
Hu H, Zhai C, Qian G, Gu A, Liu J, Ying F, et al. (2015). Protective effects of tanshinone IIA on myocardial ischemia reperfusion injury by reducing oxidative stress, HMGB1 expression, and inflammatory reaction. Pharm Biol 53: 1752-1758.
Hu T, Wei G, Xi M, Yan J, Wu X, Wang Y, et al. (2016). Synergistic cardioprotective effects of Danshensu and hydroxysafflor yellow A against myocardial ischemia-reperfusion injury are mediated through the Akt/Nrf2/HO-1 pathway. Int J Mol Med 38: 83-94.
Huang P, Zhou CM, Qin H, Liu YY, Hu BH, Chang X, et al. (2012). Cerebralcare Granule(R) attenuates blood-brain barrier disruption after middle cerebral artery occlusion in rats. Exp Neurol 237: 453-463.
Huang XP, Tan H, Chen BY, Deng CQ (2015a). Combination of total astragalus extract and total Panax notoginseng saponins strengthened the protective effects on brain damage through improving energy metabolism and inhibiting apoptosis after cerebral ischemia-reperfusion in mice. Chin J Integr Med.
Huang XP, Qiu YY, Wang B, Ding H, Tang YH, Zeng R, et al. (2014). Effects of Astragaloside IV combined with the active components of Panax notoginseng on oxidative stress injury and nuclear factor-erythroid 2-related factor 2/heme oxygenase-1 signaling pathway after cerebral ischemia-reperfusion in mice. Pharmacogn Mag 10: 402-409.
Huang Z, Han Z, Ye B, Dai Z, Shan P, Lu Z, et al. (2015b). Berberine alleviates cardiac ischemia/reperfusion injury by inhibiting excessive autophagy in cardiomyocytes. European journal of pharmacology 762: 1-10.
Ji M, Wang Y, Wang L, Chen L, Li J (2016). Protective effect of Xuebijing injection against acute lung injury induced by left ventricular ischemia/reperfusion in rabbits. Exp Ther Med 12: 51-58.
Jiang S, Shi Z, Li C, Ma C, Bai X, Wang C (2014). Hydroxysafflor yellow A attenuates ischemia/reperfusion-induced liver injury by suppressing macrophage activation. Int J Clin Exp Pathol 7: 2595-2608.
Jiang Y, Zhou Z, Meng QT, Sun Q, Su W, Lei S, et al. (2015). Ginsenoside Rb1 Treatment Attenuates Pulmonary Inflammatory Cytokine Release and Tissue Injury following Intestinal Ischemia Reperfusion Injury in Mice. Oxid Med Cell Longev 2015: 843721.
Jinglong T, Weijuan G, Jun L, Tao Q, Hongbo Z, Shasha L (2013). The molecular and electrophysiological mechanism of buyanghuanwu decoction in learning and memory ability of vascular dementia rats. Brain Res Bull 99: 13-18.
Jun Y, Chunju Y, Qi A, Liuxia D, Guolong Y (2014). The effects of compound danshen dripping pills and human umbilical cord blood mononuclear cell transplant after acute myocardial infarction. Exp Clin Transplant 12: 123-128.
Kalogeris T, Baines CP, Krenz M, Korthuis RJ (2012). Cell biology of ischemia/reperfusion injury. Int Rev Cell Mol Biol 298: 229-317.
Katseni K, Chalkias A, Kotsis T, Dafnios N, Arapoglou V, Kaparos G, et al. (2015). The Effect of Perioperative Ischemia and Reperfusion on Multiorgan Dysfunction following Abdominal Aortic Aneurysm Repair. Biomed Res Int 2015: 598980.
Kim I, Xu W, Reed JC (2008). Cell death and endoplasmic reticulum stress: disease relevance and therapeutic opportunities. Nat Rev Drug Discov 7: 1013-1030.
Kim SJ, Lee SM (2012). Effect of baicalin on toll-like receptor 4-mediated ischemia/reperfusion inflammatory responses in alcoholic fatty liver condition. Toxicol Appl Pharmacol 258: 43-50.
Kim SJ, Moon YJ, Lee SM (2010). Protective effects of baicalin against ischemia/reperfusion injury in rat liver. Journal of natural products 73: 2003-2008.
Kim YM, Ha YM, Jin YC, Shi LY, Lee YS, Kim HJ, et al. (2009). Palmatine from Coptidis rhizoma reduces ischemia-reperfusion-mediated acute myocardial injury in the rat. Food Chem Toxicol 47: 2097-2102.
Kong R, Gao Y, Sun B, Chen H, Wang G, Wang X, et al. (2009). The strategy of combined ischemia preconditioning and salvianolic acid-B pretreatment to prevent hepatic ischemia-reperfusion injury in rats. Dig Dis Sci 54: 2568-2576.
Kumar P, Shen Q, Pivetti CD, Lee ES, Wu MH, Yuan SY (2009). Molecular mechanisms of endothelial hyperpermeability: implications in inflammation. Expert Rev Mol Med 11: e19.
Lai CC, Huang PH, Yang AH, Chiang SC, Tang CY, Tseng KW, et al. (2016a). Baicalein Reduces Liver Injury Induced by Myocardial Ischemia and Reperfusion. The American journal of Chinese medicine 44: 531-550.
Lai CC, Huang PH, Yang AH, Chiang SC, Tang CY, Tseng KW, et al. (2016b). Baicalein, a Component of Scutellaria baicalensis, Attenuates Kidney Injury Induced by Myocardial Ischemia and Reperfusion. Planta medica 82: 181-189.
Lefer AM (1995). Role of selectins in myocardial ischemia-reperfusion injury. Ann Thorac Surg 60: 773-777.
Lefer AM, Lefer DJ (1996). The role of nitric oxide and cell adhesion molecules on the microcirculation in ischaemia-reperfusion. Cardiovasc Res 32: 743-751.
Li C, Wang Y, Qiu Q, Shi T, Wu Y, Han J, et al. (2014a). Qishenyiqi protects ligation-induced left ventricular remodeling by attenuating inflammation and fibrosis via STAT3 and NF-kappaB signaling pathway. PLoS One 9: e104255.
Li C, Li Q, Liu YY, Wang MX, Pan CS, Yan L, et al. (2014b). Protective effects of Notoginsenoside R1 on intestinal ischemia-reperfusion injury in rats. Am J Physiol Gastrointest Liver Physiol 306: G111-122.
Li F, Zheng X, Fan X, Zhai K, Tan Y, Kou J, et al. (2016a). YiQiFuMai Powder Injection Attenuates Ischemia/Reperfusion-Induced Myocardial Apoptosis Through AMPK Activation. Rejuvenation research.
Li G, Qian W, Zhao C (2016b). Analyzing the anti-ischemia-reperfusion injury effects of ginsenoside Rb1 mediated through the inhibition of p38alpha MAPK. Can J Physiol Pharmacol 94: 97-103.
Li H, Deng CQ, Chen BY, Zhang SP, Liang Y, Luo XG (2009). Total saponins of Panax notoginseng modulate the expression of caspases and attenuate apoptosis in rats following focal cerebral ischemia-reperfusion. J Ethnopharmacol 121: 412-418.
Li M, Qu YZ, Zhao ZW, Wu SX, Liu YY, Wei XY, et al. (2012). Astragaloside IV protects against focal cerebral ischemia/reperfusion injury correlating to suppression of neutrophils adhesion-related molecules. Neurochem Int 60: 458-465.
Li X, Zhang J, Huang J, Ma A, Yang J, Li W, et al. (2013). A multicenter, randomized, double-blind, parallel-group, placebo-controlled study of the effects of qili qiangxin capsules in patients with chronic heart failure. J Am Coll Cardiol 62: 1065-1072.
Li XD, Yang YJ, Geng YJ, Jin C, Hu FH, Zhao JL, et al. (2010). Tongxinluo reduces myocardial no-reflow and ischemia-reperfusion injury by stimulating the phosphorylation of eNOS via the PKA pathway. Am J Physiol Heart Circ Physiol 299: H1255-1261.
Li YH, Li YY, Fan GW, Yu JH, Duan ZZ, Wang LY, et al. (2016c). Cardioprotection of ginsenoside Rb1 against ischemia/reperfusion injury is associated with mitochondrial permeability transition pore opening inhibition. Chin J Integr Med.
Liang R, Bruns H, Kincius M, Lin T, Ludwig J, Dei-Anane G, et al. (2009). Danshen protects liver grafts from ischemia/reperfusion injury in experimental liver transplantation in rats. Transpl Int 22: 1100-1109.
Liang Z, Liu LF, Yao TM, Huo Y, Han YL (2012). Cardioprotective effects of Guanxinshutong (GXST) against myocardial ischemia/ reperfusion injury in rats. J Geriatr Cardiol 9: 130-136.
Lim KH, Lim DJ, Kim JH (2013). Ginsenoside-Re ameliorates ischemia and reperfusion injury in the heart: a hemodynamics approach. J Ginseng Res 37: 283-292.
Lin SQ, Wei XH, Huang P, Liu YY, Zhao N, Li Q, et al. (2013). QiShenYiQi Pills(R) prevent cardiac ischemia-reperfusion injury via energy modulation. Int J Cardiol 168: 967-974.
Liou SF, Ke HJ, Hsu JH, Liang JC, Lin HH, Chen IJ, et al. (2011). San-Huang-Xie-Xin-Tang Prevents Rat Hearts from Ischemia/Reperfusion-Induced Apoptosis through eNOS and MAPK Pathways. Evid Based Complement Alternat Med 2011: 915051.
Liou SF, Hsu JH, Liang JC, Ke HJ, Chen IJ, Wu JR, et al. (2012). San-Huang-Xie-Xin-Tang protects cardiomyocytes against hypoxia/reoxygenation injury via inhibition of oxidative stress-induced apoptosis. J Nat Med 66: 311-320.
Liu A, Huang L, Fan H, Fang H, Yang Y, Liu S, et al. (2015a). Baicalein pretreatment protects against liver ischemia/reperfusion injury via inhibition of NF-kappaB pathway in mice. Int Immunopharmacol 24: 72-79.
Liu A, Huang L, Guo E, Li R, Yang J, Li A, et al. (2016a). Baicalein pretreatment reduces liver ischemia/reperfusion injury via induction of autophagy in rats. Sci Rep 6: 25042.
Liu J, Wang H, Li J (2016b). Inflammation and Inflammatory Cells in Myocardial Infarction and Reperfusion Injury: A Double-Edged Sword. Clin Med Insights Cardiol 10: 79-84.
Liu M, Liu X, Wang H, Xiao H, Jing F, Tang L, et al. (2016c). Metabolomics study on the effects of Buchang Naoxintong capsules for treating cerebral ischemia in rats using UPLC-Q/TOF-MS. J Ethnopharmacol 180: 1-11.
Liu S, Sun J, Li Y (2016d). The Neuroprotective Effects of Resveratrol Preconditioning in Transient Global Cerebral Ischemia-Reperfusion in Mice. Turk Neurosurg 26: 550-555.
Liu WJ, Tang HT, Jia YT, Ma B, Fu JF, Wang Y, et al. (2010). Notoginsenoside R1 attenuates renal ischemia-reperfusion injury in rats. Shock 34: 314-320.
Liu X, Hu Z, Zhou B, Li X, Tao R (2015b). Chinese Herbal Preparation Xuebijing Potently Inhibits Inflammasome Activation in Hepatocytes and Ameliorates Mouse Liver Ischemia-Reperfusion Injury. PLoS One 10: e0131436.
Liu X, Jiang Y, Yu X, Fu W, Zhang H, Sui D (2014). Ginsenoside-Rb3 protects the myocardium from ischemia-reperfusion injury via the inhibition of apoptosis in rats. Exp Ther Med 8: 1751-1756.
Liu XY, Zhou XY, Hou JC, Zhu H, Wang Z, Liu JX, et al. (2015c). Ginsenoside Rd promotes neurogenesis in rat brain after transient focal cerebral ischemia via activation of PI3K/Akt pathway. Acta Pharmacol Sin 36: 421-428.
Liu Y, Tang GH, Sun YH, Lin XJ, Wei C, Yang GY, et al. (2013). The protective role of Tongxinluo on blood-brain barrier after ischemia-reperfusion brain injury. J Ethnopharmacol 148: 632-639.
Liu YN, Zhou ZM, Chen P (2008). Evidence that hydroxysafflor yellow A protects the heart against ischaemia-reperfusion injury by inhibiting mitochondrial permeability transition pore opening. Clin Exp Pharmacol Physiol 35: 211-216.
Lo EH, Dalkara T, Moskowitz MA (2003). Mechanisms, challenges and opportunities in stroke. Nat Rev Neurosci 4: 399-415.
Lombard DB, Alt FW, Cheng HL, Bunkenborg J, Streeper RS, Mostoslavsky R, et al. (2007). Mammalian Sir2 homolog SIRT3 regulates global mitochondrial lysine acetylation. Mol Cell Biol 27: 8807-8814.
Lou Z, Ren KD, Tan B, Peng JJ, Ren X, Yang ZB, et al. (2015). Salviaolate Protects Rat Brain from Ischemia-Reperfusion Injury through Inhibition of NADPH Oxidase. Planta Med 81: 1361-1369.
Lu M, Tang F, Zhang J, Luan A, Mei M, Xu C, et al. (2015). Astragaloside IV attenuates injury caused by myocardial ischemia/reperfusion in rats via regulation of toll-like receptor 4/nuclear factor-kappaB signaling pathway. Phytother Res 29: 599-606.
Lu T, Jiang Y, Zhou Z, Yue X, Wei N, Chen Z, et al. (2011). Intranasal ginsenoside Rb1 targets the brain and ameliorates cerebral ischemia/reperfusion injury in rats. Biol Pharm Bull 34: 1319-1324.
Luo Y, Qin Z, Hong Z, Zhang X, Ding D, Fu JH, et al. (2004). Astragaloside IV protects against ischemic brain injury in a murine model of transient focal ischemia. Neurosci Lett 363: 218-223.
Lv L, Jiang SS, Xu J, Gong JB, Cheng Y (2012a). Protective effect of ligustrazine against myocardial ischaemia reperfusion in rats: the role of endothelial nitric oxide synthase. Clin Exp Pharmacol Physiol 39: 20-27.
Lv L, Meng Q, Xu J, Gong J, Cheng Y, Jiang S (2012b). Ligustrazine attenuates myocardial ischemia reperfusion injury in rats by activating the phosphatidylinositol 3-kinase/Akt pathway. Ann Clin Lab Sci 42: 198-202.
Lv Y, Liu X, Yan S, Liang X, Yang Y, Dai W, et al. (2010). Metabolomic study of myocardial ischemia and intervention effects of Compound Danshen Tablets in rats using ultra-performance liquid chromatography/quadrupole time-of-flight mass spectrometry. J Pharm Biomed Anal 52: 129-135.
Ma L, Chuang CC, Weng W, Zhao L, Zheng Y, Zhang J, et al. (2016). Paeonol Protects Rat Heart by Improving Regional Blood Perfusion during No-Reflow. Front Physiol 7: 298.
Ma LQ, Pan CS, Yang N, Liu YY, Yan L, Sun K, et al. (2014). Posttreatment with Ma-Xing-Shi-Gan-Tang, a Chinese medicine formula, ameliorates lipopolysaccharide-induced lung microvessel hyperpermeability and inflammatory reaction in rat. Microcirculation 21: 649-663.
Ma S, Wang Y, Chen Y, Cao F (2015). The role of the autophagy in myocardial ischemia/reperfusion injury. Biochim Biophys Acta 1852: 271-276.
Mao XW, Pan CS, Huang P, Liu YY, Wang CS, Yan L, et al. (2015). Levo-tetrahydropalmatine attenuates mouse blood-brain barrier injury induced by focal cerebral ischemia and reperfusion: Involvement of Src kinase. Sci Rep 5: 11155.
Meneshian A, Bulkley GB (2002). The physiology of endothelial xanthine oxidase: from urate catabolism to reperfusion injury to inflammatory signal transduction. Microcirculation 9: 161-175.
Meng Y, Li WZ, Shi YW, Zhou BF, Ma R, Li WP (2016). Danshensu protects against ischemia/reperfusion injury and inhibits the apoptosis of H9c2 cells by reducing the calcium overload through the p-JNK-NF-kappaB-TRPC6 pathway. Int J Mol Med 37: 258-266.
Menger MD, Richter S, Yamauchi J, Vollmar B (1999). Role of microcirculation in hepatic ischemia/reperfusion injury. Hepatogastroenterology 46 Suppl 2: 1452-1457.
Mu HN, Li Q, Pan CS, Liu YY, Yan L, Hu BH, et al. (2015). Caffeic acid attenuates rat liver reperfusion injury through sirtuin 3-dependent regulation of mitochondrial respiratory chain. Free Radic Biol Med 85: 237-249.
Murphy E, Steenbergen C (2008). Mechanisms underlying acute protection from cardiac ischemia-reperfusion injury. Physiol Rev 88: 581-609.
Ning N, Dang X, Bai C, Zhang C, Wang K (2012). Panax notoginsenoside produces neuroprotective effects in rat model of acute spinal cord ischemia-reperfusion injury. J Ethnopharmacol 139: 504-512.
Nizamutdinova IT, Jin YC, Kim JS, Yean MH, Kang SS, Kim YS, et al. (2008). Paeonol and paeoniflorin, the main active principles of Paeonia albiflora, protect the heart from myocardial ischemia/reperfusion injury in rats. Planta Med 74: 14-18.
Noll T, Muhs A, Besselmann M, Watanabe H, Piper HM (1995). Initiation of hyperpermeability in energy-depleted coronary endothelial monolayers. Am J Physiol 268: H1462-1470.
Odeh M (1991). The role of reperfusion-induced injury in the pathogenesis of the crush syndrome. N Engl J Med 324: 1417-1422.
Pan C, Lou L, Huo Y, Singh G, Chen M, Zhang D, et al. (2011a). Salvianolic acid B and tanshinone IIA attenuate myocardial ischemia injury in mice by NO production through multiple pathways. Ther Adv Cardiovasc Dis 5: 99-111.
Pan H, Li D, Fang F, Chen D, Qi L, Zhang R, et al. (2011b). Salvianolic acid A demonstrates cardioprotective effects in rat hearts and cardiomyocytes after ischemia/reperfusion injury. J Cardiovasc Pharmacol 58: 535-542.
Park JH, Park O, Cho JH, Chen BH, Kim IH, Ahn JH, et al. (2014). Anti-inflammatory effect of tanshinone I in neuroprotection against cerebral ischemia-reperfusion injury in the gerbil hippocampus. Neurochem Res 39: 1300-1312.
Pell VR, Chouchani ET, Murphy MP, Brookes PS, Krieg T (2016). Moving Forwards by Blocking Back-Flow: The Yin and Yang of MI Therapy. Circ Res 118: 898-906.
Peng B, Zhao P, Lu YP, Chen MM, Sun H, Wu XM, et al. (2013). Z-ligustilide activates the Nrf2/HO-1 pathway and protects against cerebral ischemia-reperfusion injury in vivo and in vitro. Brain Res 1520: 168-177.
Pollard TD, Borisy GG (2003). Cellular motility driven by assembly and disassembly of actin filaments. Cell 112: 453-465.
Przyklenk K, Dong Y, Undyala VV, Whittaker P (2012). Autophagy as a therapeutic target for ischaemia /reperfusion injury? Concepts, controversies, and challenges. Cardiovasc Res 94: 197-205.
Pundik S, Xu K, Sundararajan S (2012). Reperfusion brain injury: focus on cellular bioenergetics. Neurology 79: S44-51.
Qi K, Li L, Li X, Zhao J, Wang Y, You S, et al. (2015). Cardiac microvascular barrier function mediates the protection of Tongxinluo against myocardial ischemia/reperfusion injury. PLoS One 10: e0119846.
Qi YY, Xiao L, Zhang LD, Song SH, Mei Y, Chen T, et al. (2012). Tanshinone IIA pretreatment attenuates hepatic ischemia-reperfusion. Front Biosci (Elite Ed) 4: 1303-1313.
Qiao Z, Ma J, Liu H (2011). Evaluation of the antioxidant potential of Salvia miltiorrhiza ethanol extract in a rat model of ischemia-reperfusion injury. Molecules 16: 10002-10012.
Qin-Wei Z, Yong-Guang LI (2016). Berberine attenuates myocardial ischemia reperfusion injury by suppressing the activation of PI3K/AKT signaling. Experimental and therapeutic medicine 11: 978-984.
Qu YZ, Li M, Zhao YL, Zhao ZW, Wei XY, Liu JP, et al. (2009). Astragaloside IV attenuates cerebral ischemia-reperfusion-induced increase in permeability of the blood-brain barrier in rats. Eur J Pharmacol 606: 137-141.
Quan W, Wei G, Zhou D, Zhu Y, Guo C, Wang Y, et al. (2013a). Magnesium lithospermate B reduces myocardial ischemia/reperfusion injury in rats via regulating the inflammation response. Pharmaceutical biology 51: 1355-1362.
Quan W, Yin Y, Xi M, Zhou D, Zhu Y, Guan Y, et al. (2013b). Antioxidant properties of magnesium lithospermate B contribute to the cardioprotection against myocardial ischemia/reperfusion injury in vivo and in vitro. J Tradit Chin Med 33: 85-91.
Quan W, Wu B, Bai Y, Zhang X, Yin J, Xi M, et al. (2014). Magnesium lithospermate B improves myocardial function and prevents simulated ischemia/reperfusion injury-induced H9c2 cardiomyocytes apoptosis through Akt-dependent pathway. Journal of ethnopharmacology 151: 714-721.
Rai V, Sharma P, Agrawal S, Agrawal DK (2016). Relevance of mouse models of cardiac fibrosis and hypertrophy in cardiac research. Mol Cell Biochem.
Ramalho FS, Fernandez-Monteiro I, Rosello-Catafau J, Peralta C (2006). Hepatic microcirculatory failure. Acta Cir Bras 21 Suppl 1: 48-53.
Ren K, Jin C, Ma P, Ren Q, Jia Z, Zhu D (2016). Ginsenoside Rd alleviates mouse acute renal ischemia/reperfusion injury by modulating macrophage phenotype. J Ginseng Res 40: 196-202.
Ren-an Q, Juan L, Chuyuan L, Wenjuan F, Chunyan H, Xuemei Y, et al. (2014). Study of the protective mechanisms of Compound Danshen Tablet (Fufang Danshen Pian) against myocardial ischemia/reperfusion injury via the Akt-eNOS signaling pathway in rats. J Ethnopharmacol 156: 190-198.
Rohrbach S, Troidl C, Hamm C, Schulz R (2015). Ischemia and reperfusion related myocardial inflammation: A network of cells and mediators targeting the cardiomyocyte. IUBMB Life 67: 110-119.
Sakanashi M, Matsuzaki T, Noguchi K, Nakasone J, Sakanashi M, Uchida T, et al. (2013). Long-term treatment with san'o-shashin-to, a kampo medicine, markedly ameliorates cardiac ischemia-reperfusion injury in ovariectomized rats via the redox-dependent mechanism. Circ J 77: 1827-1837.
Schraag S (2016). Postoperative management. Best Pract Res Clin Anaesthesiol 30: 381-393.
Seok YM, Kim J, Park MJ, Boo YC, Park YK, Park KM (2008). Wen-pi-tang-Hab-Wu-ling-san attenuates kidney fibrosis induced by ischemia/reperfusion in mice. Phytother Res 22: 1057-1063.
Seok YM, Kim J, Choi KC, Yoon CH, Boo YC, Park Y, et al. (2007). Wen-pi-tang-Hab-Wu-ling-san attenuates kidney ischemia/reperfusion injury in mice. A role for antioxidant enzymes and heat-shock proteins. J Ethnopharmacol 112: 333-340.
Shen J, Zhu Y, Yu H, Fan ZX, Xiao F, Wu P, et al. (2014). Buyang Huanwu decoction increases angiopoietin-1 expression and promotes angiogenesis and functional outcome after focal cerebral ischemia. J Zhejiang Univ Sci B 15: 272-280.
Sheng M, Zhou Y, Yu W, Weng Y, Xu R, Du H (2015). Protective effect of Berberine pretreatment in hepatic ischemia/reperfusion injury of rat. Transplant Proc 47: 275-282.
Shi Y, Han B, Yu X, Qu S, Sui D (2011). Ginsenoside Rb3 ameliorates myocardial ischemia-reperfusion injury in rats. Pharm Biol 49: 900-906.
Si J, Wang N, Wang H, Xie J, Yang J, Yi H, et al. (2014). HIF-1alpha signaling activation by post-ischemia treatment with astragaloside IV attenuates myocardial ischemia-reperfusion injury. PLoS One 9: e107832.
Song L, Yang H, Wang HX, Tian C, Liu Y, Zeng XJ, et al. (2014a). Inhibition of 12/15 lipoxygenase by baicalein reduces myocardial ischemia/reperfusion injury via modulation of multiple signaling pathways. Apoptosis : an international journal on programmed cell death 19: 567-580.
Song M, Huang L, Zhao G, Song Y (2013). Beneficial effects of a polysaccharide from Salvia miltiorrhiza on myocardial ischemia-reperfusion injury in rats. Carbohydr Polym 98: 1631-1636.
Song S, Liu W, Liu F, Wang Z, Ding G, Guo W, et al. (2014b). Magnesium lithospermate B reduces inflammatory response in a mouse model of hepatic ischemia-reperfusion injury. Cell biochemistry and biophysics 69: 347-355.
Sun K, Fan J, Han J (2015). Ameliorating effects of traditional Chinese medicine preparation, Chinese materia medica and active compounds on ischemia/reperfusion-induced cerebral microcirculatory disturbances and neuron damage. Acta Pharm Sin B 5: 8-24.
Sun K, Hu Q, Zhou CM, Xu XS, Wang F, Hu BH, et al. (2010). Cerebralcare Granule, a Chinese herb compound preparation, improves cerebral microcirculatory disorder and hippocampal CA1 neuron injury in gerbils after ischemia-reperfusion. J Ethnopharmacol 130: 398-406.
Sun Q, Meng QT, Jiang Y, Xia ZY (2012). Ginsenoside Rb1 attenuates intestinal ischemia reperfusion induced renal injury by activating Nrf2/ARE pathway. Molecules 17: 7195-7205.
Sun Q, Meng QT, Jiang Y, Liu HM, Lei SQ, Su WT, et al. (2013). Protective effect of ginsenoside Rb1 against intestinal ischemia-reperfusion induced acute renal injury in mice. PLoS One 8: e80859.
Tacke F, Luedde T, Trautwein C (2009). Inflammatory pathways in liver homeostasis and liver injury. Clin Rev Allergy Immunol 36: 4-12.
Tang H, Pan CS, Mao XW, Liu YY, Yan L, Zhou CM, et al. (2014a). Role of NADPH oxidase in total salvianolic acid injection attenuating ischemia-reperfusion impaired cerebral microcirculation and neurons: implication of AMPK/Akt/PKC. Microcirculation 21: 615-627.
Tang NY, Liu CH, Hsieh CT, Hsieh CL (2010). The anti-inflammatory effect of paeoniflorin on cerebral infarction induced by ischemia-reperfusion injury in Sprague-Dawley rats. Am J Chin Med 38: 51-64.
Tang Q, Han R, Xiao H, Li J, Shen J, Luo Q (2014b). Protective effect of tanshinone IIA on the brain and its therapeutic time window in rat models of cerebral ischemia-reperfusion. Exp Ther Med 8: 1616-1622.
Tao T, Chen F, Bo L, Xie Q, Yi W, Zou Y, et al. (2014). Ginsenoside Rg1 protects mouse liver against ischemia-reperfusion injury through anti-inflammatory and anti-apoptosis properties. J Surg Res 191: 231-238.
Toth S, Jr., Pekarova T, Varga J, Toth S, Tomeckova V, Gal P, et al. (2013). Intravenous administration of tetramethylpyrazine reduces intestinal ischemia-reperfusion injury in rats. Am J Chin Med 41: 817-829.
Tu L, Pan CS, Wei XH, Yan L, Liu YY, Fan JY, et al. (2013). Astragaloside IV protects heart from ischemia and reperfusion injury via energy regulation mechanisms. Microcirculation 20: 736-747.
Viappiani S, Sariahmetoglu M, Schulz R (2006). The role of matrix metalloproteinase inhibitors in ischemia-reperfusion injury in the liver. Curr Pharm Des 12: 2923-2934.
Vollmar B, Menger MD (2011). Intestinal ischemia/reperfusion: microcirculatory pathology and functional consequences. Langenbecks Arch Surg 396: 13-29.
Wang F, Hu Q, Chen CH, Xu XS, Zhou CM, Zhao YF, et al. (2012a). The protective effect of Cerebralcare Granule(R) on brain edema, cerebral microcirculatory disturbance, and neuron injury in a focal cerebral ischemia rat model. Microcirculation 19: 260-272.
Wang GH, Lan R, Zhen XD, Zhang W, Xiang J, Cai DF (2014). An-Gong-Niu-Huang Wan protects against cerebral ischemia induced apoptosis in rats: up-regulation of Bcl-2 and down-regulation of Bax and caspase-3. J Ethnopharmacol 154: 156-162.
Wang HP, Liu CW, Chang HW, Tsai JW, Sung YZ, Chang LC (2013a). Cordyceps sinensis protects against renal ischemia/reperfusion injury in rats. Mol Biol Rep 40: 2347-2355.
Wang J, Qiao L, Li Y, Yang G (2008a). Ginsenoside Rb1 attenuates intestinal ischemia-reperfusion- induced liver injury by inhibiting NF-kappaB activation. Exp Mol Med 40: 686-698.
Wang J, Qiao L, Li S, Yang G (2013b). Protective effect of ginsenoside Rb1 against lung injury induced by intestinal ischemia-reperfusion in rats. Molecules 18: 1214-1226.
Wang J, Ji SY, Liu SZ, Jing R, Lou WJ (2015a). Cardioprotective effect of breviscapine: inhibition of apoptosis in H9c2 cardiomyocytes via the PI3K/Akt/eNOS pathway following simulated ischemia/reperfusion injury. Pharmazie 70: 593-597.
Wang J, Lu L, Wang Y, Wu Y, Han J, Wang W, et al. (2015b). Qishenyiqi Dropping Pill attenuates myocardial fibrosis in rats by inhibiting RAAS-mediated arachidonic acid inflammation. J Ethnopharmacol 176: 375-384.
Wang MX, Liu YY, Hu BH, Wei XH, Chang X, Sun K, et al. (2010). Total salvianolic acid improves ischemia-reperfusion-induced microcirculatory disturbance in rat mesentery. World J Gastroenterol 16: 5306-5316.
Wang W, Lopaschuk GD (2007). Metabolic therapy for the treatment of ischemic heart disease: reality and expectations. Expert Rev Cardiovasc Ther 5: 1123-1134.
Wang X, He F, Liao Y, Song X, Zhang M, Qu L, et al. (2013c). Baicalin pretreatment protects against myocardial ischemia/reperfusion injury by inhibiting mitochondrial damage-mediated apoptosis. International journal of cardiology 168: 4343-4345.
Wang Y, Pei DS, Ji HX, Xing SH (2008b). Protective effect of a standardized Ginkgo extract (ginaton) on renal ischemia/reperfusion injury via suppressing the activation of JNK signal pathway. Phytomedicine 15: 923-931.
Wang Y, Liu J, Ma A, Chen Y (2015c). Cardioprotective effect of berberine against myocardial ischemia/reperfusion injury via attenuating mitochondrial dysfunction and apoptosis. International journal of clinical and experimental medicine 8: 14513-14519.
Wang Y, Hu Z, Sun B, Xu J, Jiang J, Luo M (2015d). Ginsenoside Rg3 attenuates myocardial ischemia/reperfusion injury via Akt/endothelial nitric oxide synthase signaling and the Bcell lymphoma/Bcell lymphomaassociated X protein pathway. Mol Med Rep 11: 4518-4524.
Wang Y, Li C, Ouyang Y, Yu J, Guo S, Liu Z, et al. (2012b). Cardioprotective Effects of Qishenyiqi Mediated by Angiotensin II Type 1 Receptor Blockade and Enhancing Angiotensin-Converting Enzyme 2. Evid Based Complement Alternat Med 2012: 978127.
Wang Y, Li X, Wang X, Lau W, Wang Y, Xing Y, et al. (2013d). Ginsenoside Rd attenuates myocardial ischemia/reperfusion injury via Akt/GSK-3beta signaling and inhibition of the mitochondria-dependent apoptotic pathway. PLoS One 8: e70956.
Wang Z, Li M, Wu WK, Tan HM, Geng DF (2008c). Ginsenoside Rb1 preconditioning protects against myocardial infarction after regional ischemia and reperfusion by activation of phosphatidylinositol-3-kinase signal transduction. Cardiovasc Drugs Ther 22: 443-452.
Wang Z, Yu J, Wu J, Qi F, Wang H, Wang Z, et al. (2016). Scutellarin protects cardiomyocyte ischemia-reperfusion injury by reducing apoptosis and oxidative stress. Life Sci 157: 200-207.
Wei B, Li WW, Ji J, Hu QH, Ji H (2014). The cardioprotective effect of sodium tanshinone IIA sulfonate and the optimizing of therapeutic time window in myocardial ischemia/reperfusion injury in rats. Atherosclerosis 235: 318-327.
Wei G, Guan Y, Yin Y, Duan J, Zhou D, Zhu Y, et al. (2013a). Anti-inflammatory effect of protocatechuic aldehyde on myocardial ischemia/reperfusion injury in vivo and in vitro. Inflammation 36: 592-602.
Wei H, Wang S, Zhen L, Yang Q, Wu Z, Lei X, et al. (2015). Resveratrol attenuates the blood-brain barrier dysfunction by regulation of the MMP-9/TIMP-1 balance after cerebral ischemia reperfusion in rats. J Mol Neurosci 55: 872-879.
Wei XH, Liu YY, Li Q, Yan L, Hu BH, Pan CS, et al. (2013b). Treatment with cardiotonic pills((R)) after ischemia-reperfusion ameliorates myocardial fibrosis in rats. Microcirculation 20: 17-29.
White SK, Hausenloy DJ, Moon JC (2012). Imaging the myocardial microcirculation post-myocardial infarction. Curr Heart Fail Rep 9: 282-292.
Wu Y, Xia ZY, Dou J, Zhang L, Xu JJ, Zhao B, et al. (2011). Protective effect of ginsenoside Rb1 against myocardial ischemia/reperfusion injury in streptozotocin-induced diabetic rats. Mol Biol Rep 38: 4327-4335.
Xia KP, Ca HM, Shao CZ (2015). Protective effect of notoginsenoside R1 in a rat model of myocardial ischemia reperfusion injury by regulation of Vitamin D3 upregulated protein 1/NF-kappaB pathway. Pharmazie 70: 740-744.
Xia R, Zhao B, Wu Y, Hou JB, Zhang L, Xu JJ, et al. (2011). Ginsenoside Rb1 preconditioning enhances eNOS expression and attenuates myocardial ischemia/reperfusion injury in diabetic rats. J Biomed Biotechnol 2011: 767930.
Xiao J, Deng SB, She Q, Li J, Kao GY, Wang JS, et al. (2015). Traditional Chinese medicine Qili qiangxin inhibits cardiomyocyte apoptosis in rats following myocardial infarction. Exp Ther Med 10: 1817-1823.
Xie CL, Li JH, Wang WW, Zheng GQ, Wang LX (2015). Neuroprotective effect of ginsenoside-Rg1 on cerebral ischemia/reperfusion injury in rats by downregulating protease-activated receptor-1 expression. Life Sci 121: 145-151.
Xie Z, Shi M, Zhang C, Zhao H, Hui H, Zhao G (2016). Ginsenoside Rd Protects Against Cerebral Ischemia-Reperfusion Injury Via Decreasing the Expression of the NMDA Receptor 2B Subunit and its Phosphorylated Product. Neurochem Res 41: 2149-2159.
Xin X, Zou H, Zheng N, Xu X, Liu Y, Wang X, et al. (2013). Metabonomic strategy to the evaluation of chinese medicine compound danshen dripping pills interfering myocardial ischemia in rats. Evid Based Complement Alternat Med 2013: 718305.
Xing HC, Li LJ, Xu KJ, Shen T, Chen YB, Chen Y, et al. (2005). Effects of Salvia miltiorrhiza on intestinal microflora in rats with ischemia/reperfusion liver injury. Hepatobiliary Pancreat Dis Int 4: 274-280.
Xu T, Wu X, Chen Q, Zhu S, Liu Y, Pan D, et al. (2014). The anti-apoptotic and cardioprotective effects of salvianolic acid a on rat cardiomyocytes following ischemia/reperfusion by DUSP-mediated regulation of the ERK1/2/JNK pathway. PLoS One 9: e102292.
Xu X, Li D, Gao H, Gao Y, Zhang L, Du Y, et al. (2015). Protective effect of the traditional Chinese medicine xuesaitong on intestinal ischemia-reperfusion injury in rats. Int J Clin Exp Med 8: 1768-1779.
Xu XS, Ma ZZ, Wang F, Hu BH, Wang CS, Liu YY, et al. (2009). The antioxidant Cerebralcare Granule attenuates cerebral microcirculatory disturbance during ischemia-reperfusion injury. Shock 32: 201-209.
Xue J, Zhang X, Zhang C, Kang N, Liu X, Yu J, et al. (2016). Protective effect of Naoxintong against cerebral ischemia reperfusion injury in mice. J Ethnopharmacol 182: 181-189.
Xue L, Wu Z, Ji XP, Gao XQ, Guo YH (2014). Effect and mechanism of salvianolic acid B on the myocardial ischemia-reperfusion injury in rats. Asian Pac J Trop Med 7: 280-284.
Yang D, Zhang P, Wang T, Gao L, Qiao Z, Liang Y, et al. (2014). SalA attenuates ischemia/reperfusion-induced endothelial barrier dysfunction via down-regulation of VLDL receptor expression. Cell Physiol Biochem 33: 747-757.
Yang H, Zhang A, Zhang Y, Ma S, Wang C (2016a). Resveratrol Pretreatment Protected against Cerebral Ischemia/Reperfusion Injury in Rats via Expansion of T Regulatory Cells. J Stroke Cerebrovasc Dis 25: 1914-1921.
Yang J, Gao F, Zhang Y, Liu Y, Zhang D (2015a). Buyang Huanwu Decoction (BYHWD) Enhances Angiogenic Effect of Mesenchymal Stem Cell by Upregulating VEGF Expression After Focal Cerebral Ischemia. J Mol Neurosci 56: 898-906.
Yang LX, Zhang X, Zhao G (2016b). Ginsenoside Rd Attenuates DNA Damage by Increasing Expression of DNA Glycosylase Endonuclease VIII-like Proteins after Focal Cerebral Ischemia. Chin Med J (Engl) 129: 1955-1962.
Yang XY, Zhao N, Liu YY, Hu BH, Sun K, Chang X, et al. (2013). Inhibition of NADPH Oxidase Mediates Protective Effect of Cardiotonic Pills against Rat Heart Ischemia/Reperfusion Injury. Evid Based Complement Alternat Med 2013: 728020.
Yang XY, He K, Pan CS, Li Q, Liu YY, Yan L, et al. (2015b). 3, 4-dihydroxyl-phenyl lactic acid restores NADH dehydrogenase 1 alpha subunit 10 to ameliorate cardiac reperfusion injury. Sci Rep 5: 10739.
Yang Y, Li X, Zhang L, Liu L, Jing G, Cai H (2015c). Ginsenoside Rg1 suppressed inflammation and neuron apoptosis by activating PPARgamma/HO-1 in hippocampus in rat model of cerebral ischemia-reperfusion injury. Int J Clin Exp Pathol 8: 2484-2494.
Ye LF, Zheng YR, Wang LH (2015). Effects of Shenmai injection and its bioactive components following ischemia/reperfusion in cardiomyocytes. Experimental and therapeutic medicine 10: 1348-1354.
Ye R, Kong X, Yang Q, Zhang Y, Han J, Zhao G (2011). Ginsenoside Rd attenuates redox imbalance and improves stroke outcome after focal cerebral ischemia in aged mice. Neuropharmacology 61: 815-824.
Yin Y, Guan Y, Duan J, Wei G, Zhu Y, Quan W, et al. (2013). Cardioprotective effect of Danshensu against myocardial ischemia/reperfusion injury and inhibits apoptosis of H9c2 cardiomyocytes via Akt and ERK1/2 phosphorylation. Eur J Pharmacol 699: 219-226.
Yokozawa T, Dong E, Chen CP (2000). Protection of the kidney by Wen-Pi-Tang against ischemia-reperfusion injury. Phytomedicine 7: 185-189.
Yu L, Li F, Zhao G, Yang Y, Jin Z, Zhai M, et al. (2015). Protective effect of berberine against myocardial ischemia reperfusion injury: role of Notch1/Hes1-PTEN/Akt signaling. Apoptosis 20: 796-810.
Yu L, Li Q, Yu B, Yang Y, Jin Z, Duan W, et al. (2016a). Berberine Attenuates Myocardial Ischemia/Reperfusion Injury by Reducing Oxidative Stress and Inflammation Response: Role of Silent Information Regulator 1. Oxidative medicine and cellular longevity 2016: 1689602.
Yu Y, Sun G, Luo Y, Wang M, Chen R, Zhang J, et al. (2016b). Cardioprotective effects of Notoginsenoside R1 against ischemia/reperfusion injuries by regulating oxidative stress- and endoplasmic reticulum stress- related signaling pathways. Sci Rep 6: 21730.
Yu ZH, Cai M, Xiang J, Zhang ZN, Zhang JS, Song XL, et al. (2016c). PI3K/Akt pathway contributes to neuroprotective effect of Tongxinluo against focal cerebral ischemia and reperfusion injury in rats. J Ethnopharmacol 181: 8-19.
Yuan X, Jing S, Wu L, Chen L, Fang J (2014). Pharmacological postconditioning with tanshinone IIA attenuates myocardial ischemia-reperfusion injury in rats by activating the phosphatidylinositol 3-kinase pathway. Exp Ther Med 8: 973-977.
Yue QX, Xie FB, Song XY, Wu WY, Jiang BH, Guan SH, et al. (2012). Proteomic studies on protective effects of salvianolic acids, notoginsengnosides and combination of salvianolic acids and notoginsengnosides against cardiac ischemic-reperfusion injury. J Ethnopharmacol 141: 659-667.
Zeng X, Li J, Li Z (2015). Ginsenoside Rd mitigates myocardial ischemia-reperfusion injury via Nrf2/HO-1 signaling pathway. International journal of clinical and experimental medicine 8: 14497-14504.
Zhan S, Fan X, Zhang F, Wang Y, Kang L, Li Z (2015). A proteomic study of Shengmai injection's mechanism on preventing cardiac ischemia-reperfusion injury via energy metabolism modulation. Mol Biosyst 11: 540-548.
Zhang C, Teng F, Tu J, Zhang D (2014). Ultrasound-enhanced protective effect of tetramethylpyrazine against cerebral ischemia/reperfusion injury. PLoS One 9: e113673.
Zhang G-L (2002). New effective treatment of liver fibrosis by chinese herbal medicine. Chinese Journal of Integrated Traditional and Western Medicine 8: 156-159.
Zhang H, Wan Z, Yan X, Wang DG, Leng Y, Liu Y, et al. (2016a). Protective effect of Shenfu injection preconditioning on lung ischemia-reperfusion injury. Exp Ther Med 12: 1663-1670.
Zhang HM, Tang DL, Tong L, Sun MJ, Sui Y, Zhu HY, et al. (2011). Gualou xiebai banxia decoction inhibits NF-kappa B-dependent inflammation in myocardial ischemia-reperfusion injury in rats. J Tradit Chin Med 31: 338-343.
Zhang J, Han X, Li X, Luo Y, Zhao H, Yang M, et al. (2012). Core-shell hybrid liposomal vesicles loaded with panax notoginsenoside: preparation, characterization and protective effects on global cerebral ischemia/reperfusion injury and acute myocardial ischemia in rats. Int J Nanomedicine 7: 4299-4310.
Zhang MQ, Zheng YL, Chen H, Tu JF, Shen Y, Guo JP, et al. (2013). Sodium tanshinone IIA sulfonate protects rat myocardium against ischemia-reperfusion injury via activation of PI3K/Akt/FOXO3A/Bim pathway. Acta Pharmacol Sin 34: 1386-1396.
Zhang WD, Chen H, Zhang C, Liu RH, Li HL, Chen HZ (2006). Astragaloside IV from Astragalus membranaceus shows cardioprotection during myocardial ischemia in vivo and in vitro. Planta Med 72: 4-8.
Zhang Y, Wei L, Sun D, Cao F, Gao H, Zhao L, et al. (2010a). Tanshinone IIA pretreatment protects myocardium against ischaemia/reperfusion injury through the phosphatidylinositol 3-kinase/Akt-dependent pathway in diabetic rats. Diabetes Obes Metab 12: 316-322.
Zhang YK, Han XY, Che ZY (2010b). Effects of buyang huanwu tang combined with bone marrow mesenchymal stem cell transplantation on the expression of VEGF and Ki-67 in the brain tissue of the cerebral ischemia-reperfusion model rat. J Tradit Chin Med 30: 278-282.
Zhang ZQ, Song JY, Jia YQ, Zhang YK (2016b). Buyanghuanwu decoction promotes angiogenesis after cerebral ischemia/reperfusion injury: mechanisms of brain tissue repair. Neural Regen Res 11: 435-440.
Zhao GL, Yu LM, Gao WL, Duan WX, Jiang B, Liu XD, et al. (2016a). Berberine protects rat heart from ischemia/reperfusion injury via activating JAK2/STAT3 signaling and attenuating endoplasmic reticulum stress. Acta Pharmacol Sin 37: 354-367.
Zhao J, Huang X, Tang W, Ren P, Xing Z, Tian X, et al. (2007). Effect of oriental herbal prescription Guan-Xin-Er-Hao on coronary flow in healthy volunteers and antiapoptosis on myocardial ischemia-reperfusion in rat models. Phytother Res 21: 926-931.
Zhao J, Yu S, Tong L, Zhang F, Jiang X, Pan S, et al. (2008). Oxymatrine attenuates intestinal ischemia/reperfusion injury in rats. Surg Today 38: 931-937.
Zhao LD, Wang JH, Jin GR, Zhao Y, Zhang HJ (2012). Neuroprotective effect of Buyang Huanwu decoction against focal cerebral ischemia/reperfusion injury in rats--time window and mechanism. J Ethnopharmacol 140: 339-344.
Zhao N, Liu YY, Wang F, Hu BH, Sun K, Chang X, et al. (2010a). Cardiotonic pills, a compound Chinese medicine, protects ischemia-reperfusion-induced microcirculatory disturbance and myocardial damage in rats. Am J Physiol Heart Circ Physiol 298: H1166-1176.
Zhao Y, Xu L, Qiao Z, Gao L, Ding S, Ying X, et al. (2016b). YiXin-Shu, a ShengMai-San-based traditional Chinese medicine formula, attenuates myocardial ischemia/reperfusion injury by suppressing mitochondrial mediated apoptosis and upregulating liver-X-receptor alpha. Scientific reports 6: 23025.
Zhao YN, Wu XG, Li JM, Chen CX, Rao YZ, Li SX (2010b). [Effect of BuYangHuanWu recipe on cerebral microcirculation in gerbils with ischemia-reperfusion]. Sichuan Da Xue Xue Bao Yi Xue Ban 41: 53-56.
Zheng SY, Sun J, Zhao X, Xu JG (2004). Protective effect of shen-fu on myocardial ischemia-reperfusion injury in rats. Am J Chin Med 32: 209-220.
Zhou XM, Cao YL, Dou DQ (2006). Protective effect of ginsenoside-Re against cerebral ischemia/reperfusion damage in rats. Biol Pharm Bull 29: 2502-2505.
Zhou Y, Fang H, Lin S, Shen S, Tao L, Xiao J, et al. (2015). Qiliqiangxin Protects Against Cardiac Ischemia-Reperfusion Injury via Activation of the mTOR Pathway. Cell Physiol Biochem 37: 454-464.
Zhu B, Yang JR, Chen SF, Jiang YQ (2014). The attenuation of lung ischemia reperfusion injury by oxymatrine. Cell Biochem Biophys 70: 333-336.
Zhu J, Jiang Y, Wu L, Lu T, Xu G, Liu X (2012). Suppression of local inflammation contributes to the neuroprotective effect of ginsenoside Rb1 in rats with cerebral ischemia. Neuroscience 202: 342-351.
Zou HM, Zhang B, Xu XC, Su J, Sun YN, Xue S, et al. (2015). Urinary metabolomic strategy to evaluate Compound Danshen Dripping Pills for myocardial ischaemia in rats. J Pharm Biomed Anal 112: 98-105.